-
化学与社会、生产、生活密切相关,下列说法正确的是
A. 汽车尾气中的氮氧化合物是汽油或柴油不完全燃烧造成的
B. “绿色化学”的核心是利用化学原理对产生的污染物进行治理
C. 减少燃煤、严格控车、调整产业是治理雾霾的有效措施
D. 硫酸亚铁和维C同时服用,不能增强治疗缺铁性贫血的效果
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数。下列说法正确的是
A. 1moN2与3molH2在一定条件下充分反应,转移电子数为6NA
B. 标准下,22.4LCH4与Cl2在光照条件下反应生成HCl分子数为4NA
C. 25℃时,PH=13的Ba(OH)2溶液中含有OH-离子数为0.1NA
D. 28g由N2和CO组成的混合气体中含有的原子数为2 NA
难度: 简单查看答案及解析
-
下列说法正确的是
A. 苯乙烯分子中所有原子一定处于同一平面
B. C5H12O能与金属钠反应的同分异构体有8种
C. 苯与浓硝酸在常温下发生取代反应制备硝基苯
D. 乙烯、乙醇、聚乙烯均可使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是
编号
操作和现象
结论
A
向某待测液中滴加少量新制氯水,再加入几滴KSCN溶液,若溶液变为血红色
待测液中存在Fe2+
B
向Na2CO3溶液中加入足量稀盐酸,将产生的气体通入Na2SiO3溶液中,若产生白色沉淀
非金属性:Cl>C>Si
C
向浓度均为0.1 mol/LNaCl和KI混合溶液中逐滴加入0.1mol/ LAgNO3溶液,若先产生黄色沉淀
KSP(AgCl)>KSP(AgI)
D
向1ml20%的蔗糖溶液中,加几滴稀硫酸。水浴加热5mm后,再加入少量新制备的Cu(OH)2悬浊液,煮沸,若无砖红色沉淀产生
蔗糖未水解
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一种新型动力电池( LiFePO4电池)总反应式为Li1-xFePO4+LixC6
C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是

A. 电池放电时,LixC6在负极发生氧化反应
B. 电池放电时,正极反应式为 Lil-xFePO4+xLi-+xe-= LiFePO4
C. 电解时,图2的b电极反应式为2H2O-4e-=O2↑+4H+
D. 电解时,当转移0.2mol电子,A口产生气体的质量1.6g
难度: 困难查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,其中元素W的简单氢化物能使湿润的红色石蕊试纸变蓝,X、Z为同主族,且Z原子核外电子数是X的2倍;Y、Z为同周期,且Y的离子半径在同周期中最小。下列说法正确的是
A. 简单离子半径:Z>Y>W>X
B. 工业上用电解熔融X、Y组成的化合物来制取Y单质
C. W、X的氢化物中只含极性共价键
D. Z的氧化物对应的水化物为强酸
难度: 简单查看答案及解析
-
室温下,0.1 mol/L H2A溶液中存在H2A、HA和A2-三种形态的粒子,其物质的量分数δ(x)随溶液PH变化的关系如图所示[已知δ(x)=c(X)/(C(H2A)+ C(HA-)+C(A2-)),下列说法不正确的是(图中a=1.35、b=4.17)
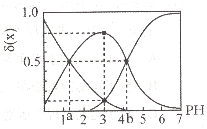
A. PH=7的溶液中C(Na+)=2[(C(A2-)+C(HA-)+C(H2A)]
B. 0.lmol/LNaHA溶液中C(OH-)+C(A2-)=C(H+)+C(H2A)
C. 已知Pka=-1gKa,则Pka2=4.17
D. PH=3的溶液中C(HA-)>C(A2-)+C(H2A)
难度: 困难查看答案及解析
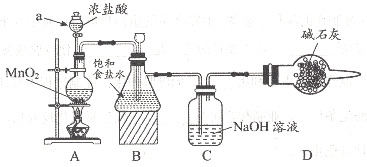
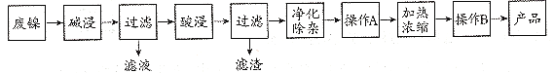
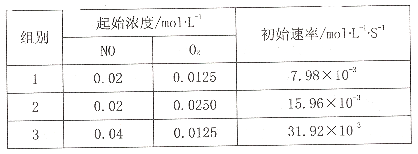
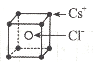
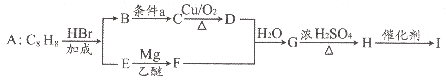
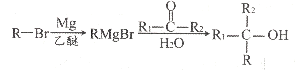
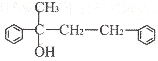
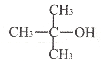 的合成路线图。_____
的合成路线图。_____