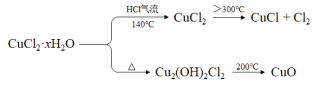
-
4019X、4018Z、4019Q、4020R+、4120M 5种微粒,所属元素的种类有
A. 2种 B. 3种 C. 4种 D. 5种
难度: 简单查看答案及解析
-
氮气常用作白炽灯泡中钨丝的保护气,这是因为
A. 氮气比空气轻 B. 氮气难溶于水
C. 氮气是无色无味的气体 D. 氮气很不活泼
难度: 简单查看答案及解析
-
下列物质属于分子晶体的是
A. NaOH B. SiO2 C. H2O D. Na
难度: 简单查看答案及解析
-
下列变化中既有化学键断裂又有化学键形成,且断键能量大于成键能量的是
A. 酒精燃烧 B. 碳酸钙分解 C. 干冰升华 D. 氨气液化
难度: 简单查看答案及解析
-
能证明氯化氢内部化学键是共价键的事实是
A. 氯化氢极易溶于水 B. 氯化氢是无色气体
C. 液态氯化氢不能导电 D. 氯化氢水溶液显酸性
难度: 简单查看答案及解析
-
下列物质的分离原理与溶解度有关的是
A. 蒸馏 B. 过滤 C. 升华 D. 萃取
难度: 简单查看答案及解析
-
下列物质对水的电离平衡没有影响的是
A. NaI B. KF C. KAl(SO4)2 D. NaHSO4
难度: 中等查看答案及解析
-
下列装置不能达到除杂目的(括号内为杂质)的是
溴水
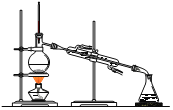
A.乙烷(乙烯)
B.苯(甲苯)
C.乙酸乙酯(Na2CO3)
D.水(NaCl)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一定浓度的盐酸分别与等体积的NaOH溶液和氨水反应,恰好中和,消耗的盐酸体积相同,则NaOH溶液与氨水
A. OH―浓度相等 B. pH相等 C. 电离度相等 D. 物质的量浓度相等
难度: 中等查看答案及解析
-
在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,剩余的固体能被磁铁吸引,则反应后溶液中大量存在的阳离子是
A. Fe2+ B. Fe3+ C. Cu2+ D. H+
难度: 中等查看答案及解析
-
向BaCl2溶液中通入SO2至饱和,此过程看不到现象,再向溶液中加入一种物质,溶液变浑浊,加入的这种物质不可能是( )
A. Cl2 B. NH3 C. CO2 D. H2S
难度: 中等查看答案及解析
-
下列有机物的命名不正确的是
A. 3-乙基-1-丁炔 B. 3-甲基-2-丁醇
C. 3-甲基-2-戊烯 D. 2,2-二甲基丁烷
难度: 中等查看答案及解析
-
下列事实能用勒夏特列原理解释的是
A. 加催化剂有利于氨的催化氧化反应
B. 实验室用排饱和食盐水的方法收集氯气
C. 500℃左右比室温更有利于合成氨的反应
D. 压缩H2(g)、I2(g)、HI(g)平衡体系,体系颜色加深
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 1.0 mol/L 的KNO3溶液:H+、Fe2+、Cl-、SO42-
B. 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C. pH=12的溶液:K+、Na+、CH3COO-、Br-
D. 使KSCN显血红色的溶液:NH4+、Mg2+、I-、Cl-
难度: 中等查看答案及解析
-
根据能量关系图,下列分析正确的是
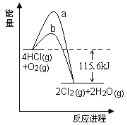
A. 该反应是吸热反应
B. 曲线a的热效应大
C. 该反应的热化学方程式为:4HCl + O2 → 2Cl2 +2H2O + 115.6 kJ
D. 若反应生成2mol液态水,放出的热量高于115.6kJ
难度: 中等查看答案及解析
-
如图可设计成多种用途的电化学装置,下列说法错误的是
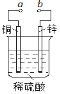
A. a与电源正极相连时,铜做阳极
B. a和b用导线连接时,锌做负极
C. a和b用导线连接时,铜片上发生的反应为:2H++2e -=H2↑
D. a与电源正极相连可以保护锌片,称为牺牲阳极的阴极保护法
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 硫酸铜溶液与氢氧化钡溶液反应:SO42— + Ba2+ → BaSO4↓
B. 盐酸中加入少量碳酸钙固体:CO32— + 2H+ →CO2↑+ H2O
C. 向氯化亚铁溶液中通入氯气:Fe2++Cl2 →Fe3++2Cl―
D. 用氢氧化钠溶液吸收少量二氧化碳:2OH— +CO2 →CO32―+H2O
难度: 中等查看答案及解析
-
以下物质的制备用错实验装置的是
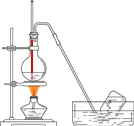
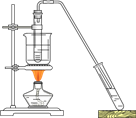
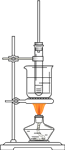
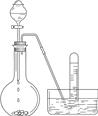
A.乙烯的制取
B.乙酸乙酯的制备
C.乙酸丁酯的制备
D.乙炔的制取
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
以下是我国化工专家侯德榜发明的联合制碱法简要流程:
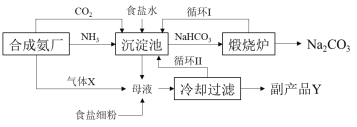
关于此流程说法正确的是
A. 副产品Y是NH4HCO3 B. 向母液中通入的气体X是CO2
C. 循环II是为了提高食盐的利用率 D. 析出NaHCO3后的母液中只含NH4Cl
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的数值,下列说法正确的是
A. 标准状况下,22.4 L氩气约含2 NA个氩原子
B. 14 g乙烯和丙烯混合气体中含有2 NA个氢原子
C. 标准状况下,2.24 L CCl4含有0.4 NA根共价键
D. 100℃时,1 L pH = 6的纯水中,含有的OH-数目为1×10-8 NA
难度: 中等查看答案及解析
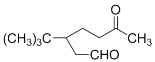 )是一种重要的有机合成中间体,其合成路线如下所示。
)是一种重要的有机合成中间体,其合成路线如下所示。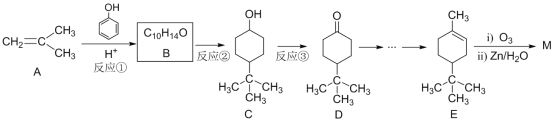
 乙……
乙……