-
氢气是人类未来最理想的燃料,以水为原料大量制取氢气的最理想的途径是( )
A. 利用太阳能直接使水分解产生氢气
B. 以焦炭和水制取水煤气(含CO和H2)后分离出氢气
C. 用铁和盐酸反应放出氢气
D. 由热电站提供电力电解水产生氢
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是其内层电子数的3倍,Y是同周期中金属性最强的元素,W与Z同主族。下列说法正确的是
A. 原子半径:W<X<Y B. Y和Z形成的化合物为离子化合物
C. 氢化物沸点:W<X D. W与Z具有相同的最高化合价
难度: 中等查看答案及解析
-
核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象:( )
A. 元素周期表中第1周期所有元素的原子 B. 18O、31P、119Sn
C. 元素周期表中VA族所有元素的原子 D. 27Al、19F、12C
难度: 简单查看答案及解析
-
元素的性质随着原子序数的递增呈现周期性变化的原因是( )
A. 元素的原子半径呈周期性变化 B. 元素的化合价呈周期性变化
C. 元素原子的电子层数呈周期性变化 D. 元素原子的核外电子排布呈周期性变化
难度: 简单查看答案及解析
-
下列分子中所有原子均满足最外层8电子结构的( )
A. BeCl2 B. PCl3 C. PCl5 D. NH3
难度: 简单查看答案及解析
-
工业上冶炼钛的有关反应如下所示:
①C(s)+O2(g)=CO2(g) △H1
②2CO(g)+O2(g)=2CO2(g) △H2
③TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H3
④TiCL4(s)+2Mg(s)=2MgC12(s)+Ti(s) △H4
⑤TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H5
下列有关推断正确的是
A. 2△H1=△H2
B. △H5=ΔH3 +2ΔH1-ΔH2
C. △H1<0,△H2>0
D. 2△H1-△H2>0
难度: 中等查看答案及解析
-
是一种人工合成的超重化学元素,元素符号为Ts,元素名称为
,下列说法正确的是
A. 中子数117 B. 质子数293 C. 质量数176 D. 原子序数117
难度: 简单查看答案及解析
-
冰毒有剧毒,人体摄入后将严重损害心脏、大脑组织甚至导致死亡,严禁吸食。它的分子式为C10H15N,其中的氮元素在周期表中处于( )
A. 第IIA族 B. 第IIIA族 C. 第IVA族 D. 第VA族
难度: 简单查看答案及解析
-
下列关于能量变化的说法正确的是
A. 冰融化成水放出热量 B. 生成物的总能量一定低于反应物的总能量
C. 金属与酸反应吸收能量 D. 化学键的断裂和形成是化学反应中能量变化的主要原因
难度: 简单查看答案及解析
-
已知X、Y的核电荷数分别是a和b,它们的离子Xn+和Ym-的核外电子排布相同,则下列关系式中正确的是( )
A. a=b+m+n B. a=b-m+n
C. a=b+m-n D. a=b-m-n
难度: 简单查看答案及解析
-
下列关于化学键的说法中正确的是
A. 构成单质分子的微粒一定含有共价键
B. 由非金属组成的化合物不一定是共价化合物
C. 非极性键只存在于双原子单质分子里
D. 不同元素组成的多原子分子里的化学键一定是极性键
难度: 简单查看答案及解析
-
下列有关23592U和23892U的说法正确的是( )
A. 23592U和23892U互为同位素 B. 23592U和23892U的质量数相同
C. 23592U和23892U是同一种核素 D. 23592U和23892U的核外电子数和中子数均为92
难度: 简单查看答案及解析
-
下列各组微粒按半径由大到小的顺序排列的是( )
A. Mg、Ca、K、Na B. Na+、Al3+、Cl-、F-
C. Br-、Br、Cl、S D. S2-、Cl-、K+、Na+
难度: 中等查看答案及解析
-
下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是( )
A. B为第二周期的元素
B. C为VA族元素
C. 三种元素都为非金属元素
D. B是三者中化学性质最活泼的非金属
难度: 简单查看答案及解析
-
某学生用如图所示装置进行化学反应X+2Y=2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升。关于该反应的下列叙述①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来。其中正确的是
A. ①②③ B. ①③ C. ①② D. ②③
难度: 中等查看答案及解析
-
下列有关化学用语的表示方法中正确的是
A.
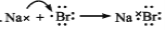
B. M2+离子核外有a个电子,b个中子,M原子符号为
C. 用电子式表示MgCl2的形成过程为
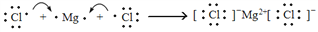
D. 次氯酸的电子式:
难度: 中等查看答案及解析
-
甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系:
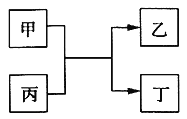
下列说法正确的是( )
A. 若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
B. 若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
C. 若甲为金属单质,乙为非金属单质,则甲只能是Mg
D. 若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
难度: 困难查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A. 已知
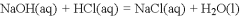
,则
固体与稀盐酸完全反应,放出的热量即为
B. 已知
则
C. 已知
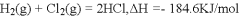 ,则反应物总能量小于生成物总能量
,则反应物总能量小于生成物总能量D. 已知
(白磷,s)=
(红磷,s)
,则白磷比红磷稳定
难度: 简单查看答案及解析
-
Li/Li2O体系的能量循环图如图所示。下列说法正确的是

A. △H3<0 B. △H3+△H4+△H5=△H6
C. △H6>△H5 D. △H1+△H2+△H3+△H4+△H5+△H6=0
难度: 中等查看答案及解析
-
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl(g)+O2(g)
2Cl2(g)+2H2O(g)
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
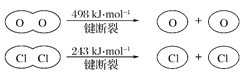
判断下列说法正确的是( )
A. 反应A的△H>-115.6kJ·mol-1
B. H2O中H—O键比HCl中H—Cl键弱
C. 由II中的数据判断氯元素的非金属性比氧元素强
D. 断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
难度: 中等查看答案及解析