-
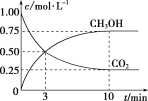
有① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是
A. 3种溶液pH的大小顺序是③>②>①
B. 若将3种溶液稀释相同倍数,pH变化最大的是②
C. 若分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D. 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
难度: 中等查看答案及解析
-
化学与人类生活、生产和社会可持续发展密切相关,下列说法正确的是( )
A. 铝及其合金是电气、工业、家庭广泛使用的材料,通常用电解氯化铝的方法制取铝
B. 船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用
C. 钢铁在潮湿的空气中主要发生化学腐蚀
D. 氢氧燃料电池是一种具有应用前景的绿色电源
难度: 中等查看答案及解析
-
通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)= 2H2(g)+ O2(g) △H1=+ 571.6kJ.mol-1
②焦炭与水反应制氢: C(s) + H2O(g) = CO(g) +H2(g) △H2=+ 131.3kJ.mol-1
③甲烷与水反应制氢:CH4(g) + H2O(g) = CO(g) + 3H2(g) △H3=+ 206.1kJ.mol-1
A. 反应①中电能转化为化学能
B. 反应②可设计成原电池
C. 反应③使用催化剂,△H3 减小
D. 反应CH4(g) = C(s)+ 2H2(g) 的 △H = + 74.8kJ.mol-1
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A. NaHCO3、Fe(OH)3、FeCl2均可通过化合反应生成
B. 电离、电解、电泳、电镀、电化学腐蚀均需要通电才可进行
C. 锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率
D. 电镀时,应把镀件置于电解槽的阴极
难度: 中等查看答案及解析
-
利用待测样品和指定的试剂设计实验能达到实验目的的是( )
实验目的
待测样品
试剂
A
检验补铁剂硫酸亚铁片是否部分氧化
硫酸亚铁片的水溶液
铁氰化钾溶液
B
检验洁厕剂的主要成分是盐酸
洁厕剂
硝酸银溶液
C
检验是否患糖尿病
患者尿液
硫酸铜溶液、纯碱溶液
D
检验海带中的碘元素
海带灰浸出液
氯水淀粉溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列实验装置或操作设计正确、且能达到目的的是( )
A. 实验①,设计铜银双液原电池
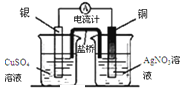
B. 实验②,将钢闸门与外接电源的负极相连,可防止钢闸门腐蚀
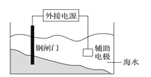
C. 实验③,准确量取一定体积K2Cr2O7标准溶液

D. 实验④,蒸干氯化镁溶液制MgCl2·6H2O
难度: 中等查看答案及解析
-
下列过程与“盐类的水解平衡”或“难溶电解质的溶解平衡”无关的是( )
A. 将NaOH溶液加入NaHSO4溶液中使其转化为Na2SO4
B. 将TiCl4加入水中并加热使其转化为TiO2•xH2O
C. 将Na2CO3溶液加入水垢中使CaSO4转化为CaCO3
D. 将Na2S溶液加入含Hg2+的废水中使其转化为HgS沉淀
难度: 中等查看答案及解析
-
下列热化学方程式和结论之间的关系正确的是( )
A. 常温常压下,1g H2在足量Cl2中燃烧生成HCl放出92.3kJ的热量,则热化学方程式可表示为H2(g)+Cl2(g)=2HCl(g)△H= -184.6kJ
B. 甲烷的燃烧热为890.3kJ·mol-1则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ·mol-1,则1molNaOH的稀溶液与足量的稀盐酸完全中和,其中和热为57.3kJ·mol-1
D. 500℃.30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H= -38.6kJ·mol-1
难度: 中等查看答案及解析
-
在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是( )
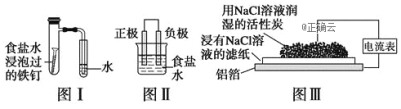
A. 按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热左边的具支试管
B. 图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C. 铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D. 图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
难度: 困难查看答案及解析
-
设阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 标准状况下,2.24LCCl4含有的共价键数为0.4NA
B. 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L
C. 用铂电极电解100 mL 1 mol • L-1的CuSO4溶液足够长时间,转移电子数一定为0.2NA
D. 常温下,14 g的146C含中子数目为6NA
难度: 中等查看答案及解析
-
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn+)的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
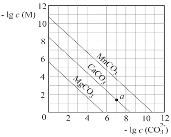
A. Ksp(MnCO3)的数量级为10-11
B. MgCO3的悬浊液中加入少量水充分振荡,c(Mg2+)不变
C. 向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,最先形成MgCO3沉淀
D. a点表示的溶液中,c(Ca2+)>c(CO32-)
难度: 困难查看答案及解析
-
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池
电解池
A
H+移向Pb电极
H+移向Pb电极
B
每消耗3molPb
生成2mol Al2O3
C
正极:PbO2+4H++2e-=Pb2++2H2O
阳极:2Al+3H2O-6e-=Al2O3+6H+
D
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
根据下列图示所得出的结论不正确的是
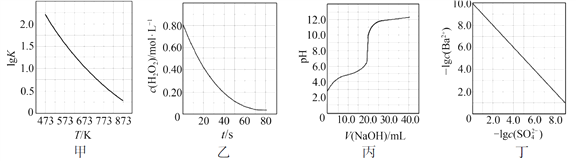
A. 图甲是CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y和Z的原子序数依次增大,W的气态氢化物的水溶液可使酚酞变红,W与X可形成一种红棕色有刺激性气味的气体,Y的原子半径是所有短周期主族元素中最大的,Z原子最外层电子数与W原子的电子总数相同。下列说法中正确的是( )
A. 简单氢化物沸点:Z<W B. 简单离子半径:W<X<Y
C. W的氧化物对应水化物均为强酸 D. Y与Z形成的化合物的水溶液呈碱性
难度: 困难查看答案及解析
-
用阳极X和阴极Y电解足量Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是( )
选项
阳极X
阴极Y
Z
W
A
C
Fe
KCl
KOH
B
Pt
Cu
CuSO4
Cu(OH)2溶液
C
C
C
H2SO4
H2O
D
Ag
Fe
AgNO3
AgNO3晶体
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是( )
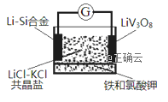
A. 放电时LiV3O8电极反应为:xLi++LiV3O8-xe-=Li1+xV3O8
B. 整个过程的能量转化涉及化学能转化为热能和电能
C. 组装该电池应当在无水、无氧的条件下进行
D. 充电时Cl-移向LiV3O8电极
难度: 困难查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A. 用惰性电极电解饱和食盐水时,阳极的电极反应为2Cl--2e-===Cl2↑
B. 熔融碳酸盐介质的氢氧燃料电池的正极电极反应为O2+4e-===2O2-
C. 由Mg、Al、氢氧化钠溶液构成的原电池,其负极电极反应为:Mg-2e-= Mg2+
D. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-===Fe3+
难度: 困难查看答案及解析
-
常温下向20 mL 0.1mol/LCH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是( )

A. a点表示的溶液中c(CH3COO-)略小于10-3 mol/L
B. c点表示CH3COOH和NaOH恰好完全中和
C. b点表示的溶液中c(CH3COO-)>c(Na+)
D. 滴定过程中溶液中的n (CH3COO-) +n(CH3COOH)的和不变
难度: 困难查看答案及解析
-
在密闭容器中进行反应:A(g)+3B(g)
2C(g),有关下列图像说法的不正确的是( )
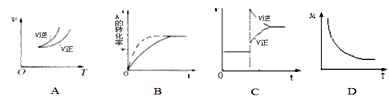
A. 依据图A可判断正反应为放热反应
B. 在图B中,虚线可表示使用了催化剂
C. 若正反应的△H<0,图C可表示升高温度使平衡向逆反应方向移动
D. 由图D中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0
难度: 困难查看答案及解析
-
某实验小组依据反应 AsO43-+2H++2I-
AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是( )

A. 调节pH可以改变反应的方向
B. pH = 0.68时,反应处于平衡状态
C. pH = 5时,负极电极反应式为2I--2e- =I2
D. pH >0.68时,氧化性I2〉AsO43-
难度: 困难查看答案及解析
-
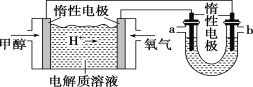
电解原理在化学工业中有着广泛的应用。图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。则下列说法不正确的是( )

A. 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液
B. 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5 mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol
C. 按图甲装置用惰性电极电解AgNO3溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量
D. 若X、Y为铂电极,a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol·L-1
难度: 困难查看答案及解析
-
下列装置图及有关说法正确的是( )
A.
 中K键闭合时,片刻后CuSO4溶液中
中K键闭合时,片刻后CuSO4溶液中增大
B.
 中K键闭合时,片刻后可观察到滤纸a点变红色
中K键闭合时,片刻后可观察到滤纸a点变红色C.
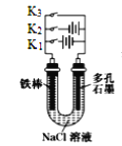 中铁腐蚀的速度由大到小的顺序是:只闭合K1只闭合K3只闭合K2都断开
中铁腐蚀的速度由大到小的顺序是:只闭合K1只闭合K3只闭合K2都断开D.
 中当铁制品上析出1.6 g铜时,电源负极输出的电子数为0.025NA
中当铁制品上析出1.6 g铜时,电源负极输出的电子数为0.025NA难度: 中等查看答案及解析
-
下列有关认识正确的是( )
A. 各能级最多能容纳电子数按s、p、d、f的顺序分别为2、6、10、14
B. 各能层的能级都是从s能级开始至f能级结束
C. 各能层含有的能级数为n-1
D. 各能层含有的电子数为2n2
难度: 简单查看答案及解析
-
下列四种装置中,溶液的体积均为250mL,开始时电解质溶液的浓度均为0.10mol/L,工作一段时间后,测得导线上均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述正确的是( )

A. 工作一段时间后溶液的浓度:①=②=③=④
B. 工作一段时间后溶液的pH:④>③>①>②
C. 产生气体的总体积:④>③>①>②
D. 电极上析出固体的质量:①>②>③>④
难度: 中等查看答案及解析
-
某二次电池放电时的化学方程式为:2K2S2+KI3=K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )

A. K+从右到左通过离子交换膜
B. A的电极反应式为:3I﹣﹣2e﹣=I3﹣
C. 当有0.1 mol K+通过离子交换膜,X电极上产生标准状况的气体1.12 L
D. 电池充电时,B电极要与外电源的正极相连,电极上发生还原反应
难度: 中等查看答案及解析
-
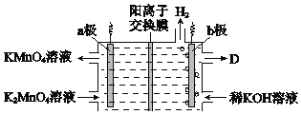
双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HCl,其工作原理如图所示,M、N为离子交换膜。下列说法错误的是( )

A. 阴极室发生的反应为2H++2e-=H2↑
B. M为阳离子交换膜,N为阴离子交换膜
C. 若去掉双极膜(BP),阳极室会有Cl2生成
D. 电路中每转移1mol电子,两极共得到0.5mol气体
难度: 困难查看答案及解析