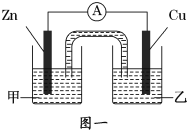
-
对于:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l);△H =-5800kJ/mol的叙述错误的是
A. 该反应的反应热为△H=-5800kJ/mol,是放热反应
B. 该反应的△H与各物质的状态有关,与化学计量数也有关
C. 该式的含义为:25℃、101kPa下,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ
D. 该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol
难度: 简单查看答案及解析
-
下列盐类水解的应用,不正确的是
A. 实验室配制氯化铁溶液时,滴入少量稀硫酸抑制水解
B. 为使纯碱溶液的去油污效果更好,可以使用热的纯碱溶液
C. 明矾可用于净水,是由于溶于水后产生的Al(OH)3胶体具有吸附作用
D. 铵态氮肥不能和草木灰混合施用,是由于NH4+与CO32﹣互相促进水解,肥效下降
难度: 中等查看答案及解析
-
如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是
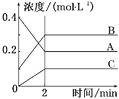
A. A是反应物
B. 前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D. 反应的方程式为2A(g)
2B(g)+C(g)
难度: 中等查看答案及解析
-
燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)反应将化学能转变为电能的装置。下面关于甲烷燃料电池(KOH溶液为电解质溶液)的说法正确的是
A. 负极的电极反应式为O2+2H2O+4e-=4OH-
B. 随着放电的进行,溶液的pH不变
C. 负极的电极反应式为CH4+8OH--8e-=CO2+6H2O
D. 放电时溶液中的OH-向负极移动
难度: 中等查看答案及解析
-
有反应4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),已知2 mol O2被还原时,放出a kJ的热量,且知断开1 mol O=O键需要吸收b kJ的热量,断开1 mol Cl—Cl键需要吸收c kJ的热量。则断开1 mol H—O键比断开1 mol H—Cl键所需能量高
A. (b-a-2c)/4kJ B. (a+2b-4c)/8kJ C. (a+b-2c)/4kJ D. (2b-a-4c)/8kJ
难度: 中等查看答案及解析
-
在下列各微粒中,室温下能使水的电离平衡向电离的方向移动,且使溶液的pH>7的是
A. Al3+ B. HCO3- C. HSO4- D. 26X3+
难度: 中等查看答案及解析
-
一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g)
2Z(g),此反应达到平衡状态的标志是
A. 容器内气体密度不随时间变化
B. 容器内气体的平均相对分子质量不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2
D. 消耗0.1 mol X的同时生成0.2 mol Z
难度: 中等查看答案及解析
-
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
A. 溶液中
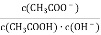 不变
不变B. 溶液中导电粒子的数目减少
C. 醋酸的电离程度增大,c(H+)也增大
D. 再加入10 mL pH=11的NaOH溶液后pH=7
难度: 中等查看答案及解析
-
近年来,加“碘”食盐中添加较多的是碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极材料,以KI溶液为电解液,在一定条件下进行电解,反应的化学方程式为KI+3H2O
KIO3+3H2↑。下列有关说法不正确的是
A. 加碘食盐不能使淀粉溶液变蓝
B. 电解时,石墨作阳极,不锈钢作阴极
C. 阳极的电极反应式为I-+3H2O+6e-=IO3-+6H+
D. 转移3 mol电子,理论上可制得107 g KIO3
难度: 中等查看答案及解析
-
室温下,将0.10mol·L-1盐酸滴入20.00 mL 0.10mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是
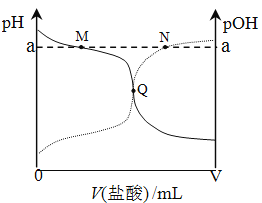
A. M点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-)
B. N点所示溶液中c(NH4+)>c(Cl-)
C. Q点消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的电离程度相同
难度: 中等查看答案及解析
-
将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中c(Na+)>c(X-),则下列关系错误的是
A. c(OH-)>c(H+) B. c(HX)<c(X-)
C. c(X-)+c(HX)=2c(Na+) D. c(HX)+c(H+)=c(Na+)+c(OH-)
难度: 中等查看答案及解析
-
在容积不变的密闭容器中有如下反应:2SO2(g)+O2 (g)
2 SO3(g);△H<0。某研究小组进行了当其他条件不变时,改变某一条件对上述反应影响的研究,下列分析正确的是
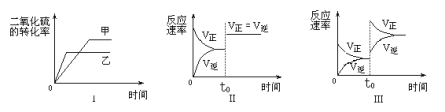
①图Ⅰ研究的是温度对化学平衡的影响,且乙的温度较高
②图Ⅱ研究的是催化剂对反应速率的影响,化学平衡不移动
③图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
④图Ⅲ研究的是t0时刻增大O2的浓度对反应速率的影响
A. ①② B. ②③ C. ②④ D. ③④
难度: 简单查看答案及解析
-
在钢铁腐蚀过程中,下列五种变化可能发生的是
①Fe2+转化为Fe3+ ②O2被还原 ③产生H2
④Fe(OH)3失水形成Fe2O3·nH2O ⑤杂质碳被氧化
A. 只①② B. 只②③④ C. ①②③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
在一定温度下,有pH相同的H2SO4和Al2(SO4)3溶液,在H2SO4溶液中由水电离的H+浓度为10-a mol/L,在Al2(SO4)3中由水电离的H+浓度为10-b mol/L,则此温度下的Kw为
A. 10-14 B. 10-2a C. 10-(a+b) D. 10-(7+a)
难度: 中等查看答案及解析
-
25 ℃时,三种难溶银盐的Ksp与颜色如表所示,下列说法正确的是
AgCl
Ag2CrO4
AgI
颜色
白色
砖红色
黄色
Ksp
1.8×10-10
1.0×10-12
8.5×10-17
A. AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减小
B. Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6 mol·L-1
C. 向AgCl悬浊液上加入足量KI溶液,沉淀将由白色转化为黄色
D. 向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀
难度: 中等查看答案及解析
-
如图所示的装置中, a、b为石墨电极,通电一段时间后,b极附近显红色。下列说法不正确的是
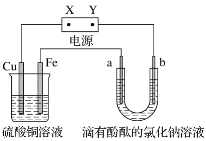
A. b电极反应式为2H++2e-=H2↑ B. a电极反应式为2Cl--2e-=Cl2↑
C. 铁电极反应式为Cu2++2e-=Cu D. 铜电极反应式为4OH--4e-=O2↑+2H2O
难度: 中等查看答案及解析