-
下列叙述正确的是
A. 向混有苯酚的苯中加入浓溴水,过滤,可除去其中的苯酚
B. 向酸性KMnO4溶液中滴加维生素C溶液,酸性KMnO4溶液褪色,说明维生素C具有还原性
C. 向淀粉溶液中加稀硫酸,加热,加新制Cu(OH)2悬浊液,加热未见红色沉淀,说明淀粉未水解
D. 向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷发生了水解
难度: 困难查看答案及解析
-
化学与生产、生活密切相关。下列说法正确的是
A. 常用的食品保鲜膜、保鲜袋的主要成分是聚氯乙烯
B. 用铜片制成的“纳米铜”具有非常强的化学活性,在空气中可以燃烧,说明“纳米铜”"的还原性比铜片更强
C. 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食品受潮、氧化变质
D. 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列叙述错误的是
①18g金刚石中,碳碳共价键数为3NA
②1mol铜与足量硫蒸气反应,转移的电子数为NA
③常温常压下,S2和S6的混合物共6.4g,其中所含硫原子数一定为0.2NA
④一定温度下,1L 0.50mol・ L-1NH4Cl溶液与2L 0.25mol・L-1NH4Cl溶液中的NH4+的数目均少于0.5NA,且前者更少
⑤电解法精炼铜时,当阳极质量减少64g时,电路中通过的电子数一定为2NA
A. ② B. ②④⑤ C. ④⑤ D. ②④
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A. 0.01mol・ L—1NH4Al(SO4)2溶液与0.02mol・L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42— +2Ba2++4OH—=2BaSO4↓+Al(OH)3↓+NH3·H2O
B. 向甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH—
HCOO-+NH4++2Ag↓+3NH3十H2O
C. 泡沫灭火器的灭火原理:2Al3++3CO32—+3H2O===2Al(OH)3↓+3CO2↑
D. 向苯酚钠溶液中通入少量CO2:2C6H5O—+CO2+H2O→2C6H5OH+CO32—
难度: 中等查看答案及解析
-
一定条件下,在水溶液中1mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
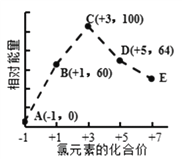
A. 这些离子中结合H+能力最强的是E
B. A、B、C、D、E五种微粒中C最稳定
C. C→B+D,反应物的总键能大于生成物的总键能
D. B→A+D反应的热化学方程式为:3ClO—(aq) == ClO3—(aq) + 2Cl—(aq) △H = -116kJ•mol-1
难度: 中等查看答案及解析
-
“类推”这种思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能确定其正确与否。下列几种类推结论中,错误的是
A. Na可与冷水反应产生氢气,则K也可与冷水反应产生氢气
B. Al(OH)3、Cu(OH)2受热易分解,则Fe(OH)3受热也易分解
C. Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
D. CO2可以使澄清的石灰水变浑浊,则SO2也可以使澄清的石灰水变浑浊
难度: 中等查看答案及解析
-
稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3价和+4价:②氧化性:Ce4+>Fe3+。下列说法不正确的是
A. 工业上金属铈一般应低温密封保存
B. 工业上不能采取用H2还原氧化铈的方法来治炼金属伂
C. 工业上可以采取电解氯化铈水溶液的方法来获得铈单质
D. 铈溶于氢碘酸的主要化学方程式可表示为2Ce+6HI===2CeI3+3H2↑
难度: 中等查看答案及解析
-
W、X、Y、Z、R为原子序数依次增大的短周期主族元素,W元素的一种核素可用于鉴定文物年代,X元素的一种单质可作为饮用水消毒剂,Y元素的简单离子是同周期元素的简单离子中半径最小的,Z元素和W元素同主族,R元素被称为“成盐元素”。下列说法错误的是
A. W元素和X元素形成的化合物WX2属于非极性分子
B. 工业上常用电解熔融Y元素和R元素形成的化合物的方法来制取单质Y
C. 制造日常生活中所使用的计算机芯片需要消耗大量单质Z
D. X元素和R元素形成的某种化合物可用于自来水的消毒
难度: 困难查看答案及解析
-
下列关于有机物的说法中,正确的一组是
①淀粉、油脂、蛋白质在一定条件下都能发生水解反应;②“乙醇汽油”是在汽油中加入适量乙醇而制成的一种燃料,它是一种新型化合物;③除去乙酸乙酯中残留的乙酸,加过量饱和碳酸钠溶液振荡后,静置分液;④石油的分馏和煤的气化都是发生了化学变化;⑤淀粉遇碘酒变蓝色,在加热条件下,葡萄糖能与新制Cu(OH)2悬浊液发生反应;⑥塑料、橡胶和纤维都是合成高分子材料;
A. ③④⑤ B. ①②⑥ C. ①③⑤ D. ②③④
难度: 中等查看答案及解析
-
I2在KI溶液中存在平衡I2(aq)+I(aq)=I3—(aq)。某I2、KI混合溶液中,I3—的物质的量浓度c(I3—)与温度T的关系如图所示(曲线上的任何点都表示平衡状态)。下列说法正确的是
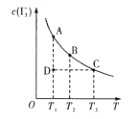
①I2(aq)+I—(aq)=I3—(ag) ΔH>0
②若温度为T1、T2时反应的平衡常数分别为K1、K2,则K1>K2
③若反应进行到状态D时,一定有v正>v逆
④状态A与状态B相比,状态A的c(I2)大
⑤保持温度不变,向该混合溶液中加水,
将变大
A. 只有①② B. 只有②③ C. ①③④ D. ①③⑤
难度: 中等查看答案及解析
-
屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。研究发现青蒿素中的某个基团对热不稳定,该基团还能与NaI作用生成I2。下列分析不正确的是
A. 推测青蒿素在乙醚中的溶解度小于在水中的溶解度
B. 通过元素分析与质谱法可确认青蒿素的分子式
C. 青蒿素中含有的 “
” 基团是酯基
D. 青蒿素中对热不稳定且具有氧化性的基团是“—O—O—”
难度: 困难查看答案及解析
-
一定温度下,两种碳酸盐MCO3(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。已知:pM=−lgc(M),p(CO32−)=−lgc(CO32−)。已知ACO3比BCO3溶解度更大。(不考虑阴阳离子的水解)。下列说法正确的是
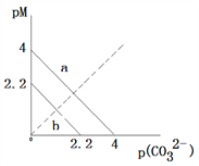
A. 线a表示ACO3的溶解平衡曲线
B. 该温度下,向ACO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀
C. 向0.1L 1mol/L的BCl2溶液中加入Na2CO3固体,当加入Na2CO3固体的质量为116.6g时,B2+离子恰好沉淀完全(B2+离子为10—5mol/L时认为沉淀完全)
D. ACO3的Ksp=10—4.4
难度: 困难查看答案及解析
-
已知草酸为二元弱酸:H2C2O4
HC2O4﹣+ H+ Ka1 ; HC2O4﹣
C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
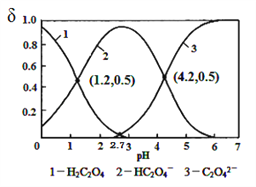
A. T℃时,lgKa2=-4.2
B. pH=1.2溶液中:c(K+)+c(H+)=c(OH﹣)+c(H2C2O4)
C. pH=2.7溶液中:
D. 向pH=1.2的溶液中再加KOH溶液,将pH增大至4.2的过程中水的电离度一直增大
难度: 困难查看答案及解析
-
短周期元素A、B、C、D的原子序数依次增大,X、Y、Z、W是由这四种元素中的两种元素组成的常见化合物,X为有刺激性气味的气体,Y为淡黄色固体,甲是由C元素形成的气体单质,乙为红棕色气体,上述物质之间的转化关系如图所示(部分反应物或生成物省略)。下列说法正确的是
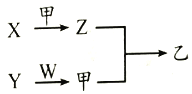
A. 原子半径大小顺序:D>C>B>A
B. 最简单气态氢化物的稳定性:B>C
C. 图示转化关系涉及的反应均为氧化还原反应
D. 元素C、D形成的化合物中一定只含离子键
难度: 困难查看答案及解析
-
煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”:C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH1=+90.1kJ·mol—1
②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ·mol—1
③催化液化Ⅱ:CO2(g)+2H2(g)===CH3OH(g)+
O2(g)△H3=akJ·mol
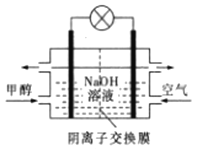
A. 催化液化I的反应在高温下更容易自发进行
B. C(s)+H2O(g)+H2(g)==CH3OH(g)△H=+41.1kJ·mol—1
C. △H2>△H3
D. 如图所示为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e—+6OH—=CO2↑+5H2O
难度: 中等查看答案及解析
-
如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是
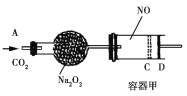
A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
难度: 困难查看答案及解析
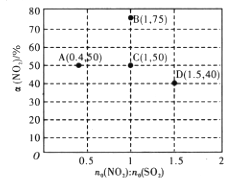
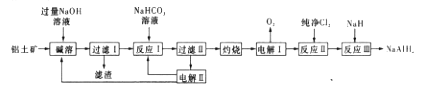
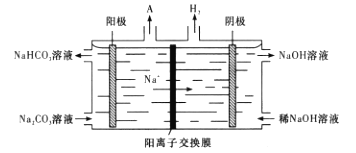
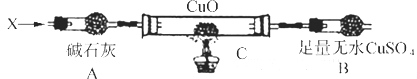
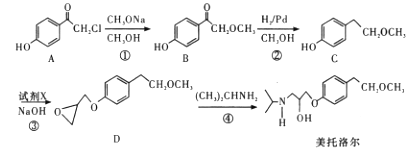
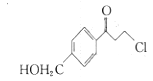 为有机原料及必要的无机试剂制备
为有机原料及必要的无机试剂制备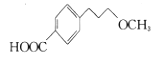 的合成路线流程图_______。
的合成路线流程图_______。