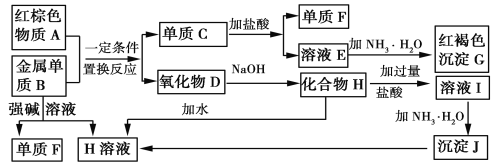
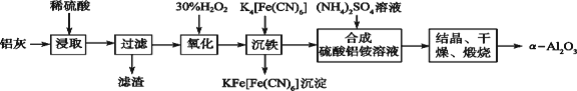
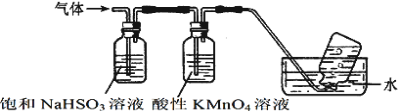
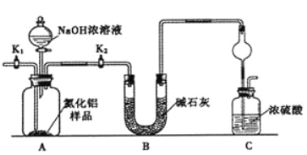
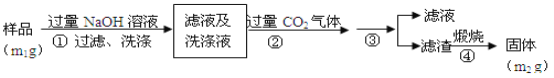
-
下列物质中既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al ④Al(OH)3 ⑤MgO ⑥(NH4)2CO3
A. ①②③④⑥ B. ②③④⑤ C. ①②③④ D. 全部
难度: 困难查看答案及解析
-
下列有关实验操作、现象、解释和结论都正确的是( )
操作
现象
解释、结论
A
过量的Fe粉中加入硝酸充分反应,滴入KSCN溶液
溶液呈红色
稀硝酸将Fe氧化为Fe3+
B
向饱和Na2CO3溶液中通入足量CO2
溶液变浑浊
析出了Na2CO3晶体
C
Al箔插入稀硝酸中
无现象
Al在硝酸中钝化,形成致密的氧化膜
D
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。则上述盐酸溶液的浓度为
A. 0.5 mol·L-1 B. 1.0 mol·L-1
C. 2.0 mol·L-1 D. 3.0 mol·L-1
难度: 中等查看答案及解析
-
化学与社会、生活、技术密切相关,下列相关说法正确的是( )
A. 水泥、玻璃、砖瓦、刚玉都属于硅酸盐类物质
B. ClO2代替Cl2作消毒剂,不仅能够提高消毒效率,而且可以避免产生新的有害物质
C. 石灰抹墙与水泥砌墙的硬化过程原理相同
D. 我国远古时期利用草木灰作肥料,实质是利用其中的Na2CO3
难度: 简单查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系正确的个数是( )
①Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂 ②ClO2具有还原性,可用于自来水的杀菌消毒 ③SiO2硬度大,用于制造光导纤维 ④NH3易溶于水,可用作制冷剂 ⑤次氯酸盐具有氧化性,因而能漂白织物 ⑥二氧化硅是酸性氧化物,它不溶于任何酸 ⑦SO2具有还原性,可用于漂白纸浆 ⑧晶体硅是半导体材料,可做晶体管
A. 1 B. 2 C. 3 D. 4
难度: 简单查看答案及解析
-
下列关于金属铝的叙述中,正确的是( )
A. 与铝反应产生H2的溶液一定呈酸性
B. 铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落
C. 由于Al2O3稳定性强,可用于制耐火坩埚
D. 铝表面有一层致密的氧化膜,使Al不能溶于稀硝酸
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是( )
①向明矾溶液中加入足量的烧碱溶液:Al3++3OH-=Al(OH)3↓
②在含有等物质的量的Fe(NO3) 2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H+ +NO3-=3Fe3++NO↑ + 2H2O
③碳酸氢铵溶液中滴加足量的NaOH溶液:HCO3-+OH-=CO32-+H2O
④向AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
⑤氢氧化钡溶液与稀硫酸反应:Ba2++OH﹣+H++SO42-=BaSO4↓+H2O
⑥铝片放入NaOH溶液中有气体产生:2Al +2OH-+ 6H2O=2[Al(OH)]4-+3H2↑
⑦向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe3+
⑧向Na2SiO3溶液中通入CO2制备硅酸凝胶:SiO32-+ CO2 + H2O = H2SiO3(胶体)+ CO32-
⑨将铜插入稀硝酸中:Cu+4H++2NO3- =Cu2++2NO2↑+2H2O
A. ①④⑤ B. ③⑤⑥ C. ④⑥⑧ D. ④⑥⑨
难度: 中等查看答案及解析
-
下列化学反应在金属冶炼工业中还没有得到应用的是( )
A. 2NaCl(熔融)
2Na+Cl2↑ B. Al2O3+3C
2Al+3CO↑
C. Fe2O3+3CO
2Fe+3CO2 D. 2Ag2O
4Ag+O2↑
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 弱碱性溶液中:Cl-、SO42-、Al3+、Fe3+
B. 1.0 mol·L-1的Na[Al(OH)4]溶液中:Cl-、H+、K+、Ca2+
C. 在强碱性环境中:[Al(OH)4]-、SiO32-、Na+、K+
D. 0.1mol·L-1明矾溶液中:NH
、[Al(OH)4]-、HCO
、Na+
难度: 中等查看答案及解析
-
如下图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线。下列判断错误的是( )
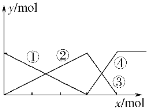
A. ①线表示Al3+的物质的量的变化
B. x表示AlCl3的物质的量
C. ③线表示Al(OH)3的物质的量的变化
D. ④线表示[Al(OH)4]-的物质的量的变化
难度: 中等查看答案及解析
-
甲、乙两烧杯中各盛有100 mL3mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积之比为1∶2,则加入的铝粉的质量为( )
A. 5.4 g B. 3.6 g C. 2.7 g D. 1.8 g
难度: 简单查看答案及解析
-
以铝土矿为原料,提取氧化铝,冶炼铝的工艺流程如下图,下列说法错误的是( )
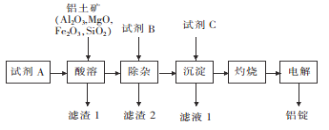
已知:滤渣2主要成分是Mg(OH)2、Fe(OH)3。
A. 试剂A可以是稀硫酸或盐酸 B. 加入试剂B除去Mg2+、Fe3+
C. 滤渣1主要成分是SiO2 D. 试剂C应是NH3或氨水
难度: 中等查看答案及解析
-
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是( )
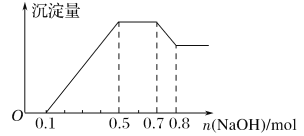
A. 溶液中的阳离子只有H+、Mg2+、Al3+
B. 溶液中n(NH4+)=0.2mol
C. 溶液中一定不含CO32-,可能含有SO42-和NO3-
D. n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
难度: 中等查看答案及解析
-
某元素原子的最外层电子数是次外层的a倍(a>1),则该原子的核内质子数是( )
A. a+2 B. 2a+10 C. 2a+2 D. 2a
难度: 简单查看答案及解析
-
核内中子数为N的R2+,质量数为A,则它们的ng氧化物中所含质子的物质的量是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4,W-的最外层为8电子结构,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A. X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B. 原子半径大小:X<Y,Z>W
C. X、Y、Z、W的简单离子核外电子数相同
D. Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
难度: 中等查看答案及解析