-
下列有关物质性质与用途具有对应关系的是
A. 晶体硅熔点高硬度大,可用于制造半导体材料
B. 碳酸钠溶液显碱性,可用于除去金属器件表面的油脂
C. 碳酸氢钠能与碱反应,可用作焙制糕点的膨松剂
D. 明矾溶于水能形成胶体,可用于自来水的杀菌消毒
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
B.Fe(OH)3胶体无色、透明,能发生丁达尔现象
C.H2、SO2、CO2三种气体都可用浓硫酸干燥
D.SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物
难度: 中等查看答案及解析
-
下列属于复盐的是
A. NaHCO3 B. Mg(OH)Cl
C. (NH4)2Fe(SO4)2·6H2O D. Na2SO4·10H2O
难度: 简单查看答案及解析
-
下列仪器名称不正确的是
A. 干燥器
 B. 坩埚
B. 坩埚C. 三脚架
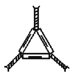 D. 坩埚钳
D. 坩埚钳难度: 简单查看答案及解析
-
下列物质属于弱电解质的是
A. 氨水 B. 碳酸铵
C. HI D. CH3COOH
难度: 简单查看答案及解析
-
下列溶于水后因水解而使溶液显酸性的是
A. NaHSO3 B. P2O5
C. NH4Cl D. CH3CH2ONa
难度: 简单查看答案及解析
-
下列利用氧化还原反应原理实现的是
A. 丹砂(HgS)炼汞 B. 石灰石生产生石灰
C. 酒精蒸馏 D. 活性炭使蔗糖脱色
难度: 简单查看答案及解析
-
下列有关化学用语的表示,正确的是
A. 氨基(-NH2)的电子式:
B. 钾离子的结构示意图:
C. 二氧化碳分子的比例模型:
D. 碳酸的电离方程式:H2CO3
CO32-+ 2H+
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 石灰水中加入过量小苏打溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B. 次氯酸钠溶液吸收少量二氧化硫气体:SO2+H2O+ClO-=SO42-+Cl-+2H+
C. 将SO2通入少量氨水中:SO2+NH3·H2O=HSO3-+NH4+
D. 电解氯化镁溶液:2Cl-+2H2O
H2↑+ Cl2↑+2OH-
难度: 中等查看答案及解析
-
下列说法正确的是
A. 用广泛pH试纸测得某溶液的pH为0
B. 除去CuCl2溶液中的FeCl3杂质,可先加入足量的浓氨水,过滤,再向滤液中加入过量的盐酸
C. 液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中
D. 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏大
难度: 中等查看答案及解析
-
下列实验操作不当的是
A. 用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率
B. 用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂
C. 用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+
D. 常压蒸馏时,加入液体的体积不超过蒸馏烧瓶容积的三分之二
难度: 中等查看答案及解析
-
下列说法正确的是
A. 相同质量的甲烷、乙烷、丙烷完全燃烧,消耗氧气最多的是丙烷
B. 1 mol 乙烷在光照条件下最多能与 3 mol Cl2 发生取代反应
C. 甲烷、苯和油脂均不能使酸性 KMnO4 溶液因反应而褪色
D. 分子式为 C4H10O 且能与金属钠反应的有机物有4 种
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A.
将乙醇和浓硫酸共热产生的气体通入酸性高锰酸钾溶液中,溶液褪色
反应生成了乙烯
B.
淀粉溶液中滴加稀硫酸加热,取加热后的溶液于试管中,加入新制氢氧化铜悬浊液后,加热至沸腾,没有出现砖红色沉淀
淀粉未水解
C.
向溶液X中加入稀盐酸,并将产生的无色无味气体通入澄清石灰水中生成白色沉淀
溶液X中一定含有CO32-或HCO3-
D.
向鸡蛋白溶液中滴入HgCl2溶液有白色沉淀
蛋白质发生盐析
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表所示:
元素代号
X
Y
Z
W
V
原子半径/pm
160
143
70
66
110
主要化合价
+2
+3
+5、-3
-2
+5、+3、-3
下列叙述正确的是
A. X、Y元素的最高价氧化物对应的水化物的碱性:X<Y
B. 简单离子的半径:Z<W<X<Y
C. 一定条件下,W的单质可以将Z的单质从其氢化物中置换出来
D. X与Z形成的化合物为共价化合物
难度: 中等查看答案及解析
-
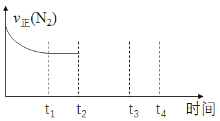
某温度下,在2L恒容密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g)
cC(g) ∆H=-QkJ·mol-1(Q>0),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是
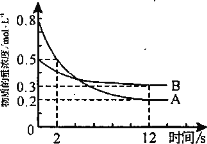
A. 2s时,A的反应速率为0.15mol·L-1·s-1
B. 图中交点时A的消耗速率等于A的生成速率
C. 化学计量数之比b ∶c = 1∶2
D. 12s内反应放出0.2QkJ热量
难度: 中等查看答案及解析
-
下列说法正确的是
A. 高级脂肪酸乙酯是生物柴油中的一种成分,它属于油脂
B. 蔗糖、淀粉、纤维素均为高分子化合物
C. 石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
D. 一定条件下,乙酸乙酯、淀粉、蛋白质都能发生水解反应
难度: 简单查看答案及解析
-
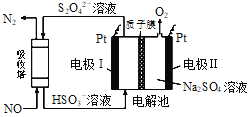
NO2、O2和熔融NaNO3可制作燃料电池,其原理如图, 下列判断正确的是
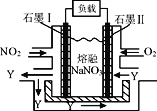
A. 石墨电极Ⅱ为电池负极
B. 电池中NO3- 从石墨电极I向石墨电极Ⅱ作定向移动
C. 石墨I电极发生的电极反应为NO2+NO3- -e- =N2O5
D. 每消耗1 mol NO2转移电子2 mol
难度: 中等查看答案及解析
-
相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是
A. pH相等的两种酸,c(CH3COO-)=c(Cl-)
B. 用pH相同的两种酸,中和相同物质的量的NaOH时,消耗盐酸的体积小
C. pH相同的两种酸,稀释相同倍数后,醋酸溶液的pH值大
D. 相同浓度相同体积的两种酸,分别与NaOH固体反应后呈中性的溶液中c(CH3COO-)=c(Cl-) (忽略溶液体积变化)
难度: 中等查看答案及解析
-
下列说法正确的是
A. PCl3、Cl2及Cl2O三种分子中各原子最外层都具有8电子稳定结构
B. HF分子比 HCl分子稳定是因为分子间作用力前者强于后者
C. 核外电子排布相同的两种微粒化学性质也相同
D. CaCl2和 CaSO4 中化学键的类型完全相同
难度: 中等查看答案及解析
-
固态或气态碘分别与氢气反应的热化学方程式如下:
① H2(g) +I2(?)
2HI(g) △H1=-9.48kJ·mol-1
② H2(g) +I2(?)
2HI(g) △H2=+26.48kJ·mol-1
下列判断不正确的是
A. ①中的I2为气态,②中的I2为固态
B. ②的反应物总能量比①的反应物总能量低
C. 反应①的产物比反应②的产物热稳定性更好
D. l mol固态碘升华时将吸热35.96kJ
难度: 困难查看答案及解析
-
碳酸二甲酯(CO(OCH3))是一种无毒、环保性能优异、用途广泛的化工原料。在催化剂作用下,可由甲醇和CO2直接合成:CO2+2CH3OH→CO(OCH3)2+H2O。某研究小组在某温度下,在0.1L恒容密闭容器中投入2.5 mol CH3OH(g)、适量CO2和6×10-5mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。下列说法不正确的是
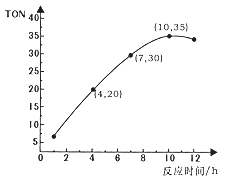
A. 在该温度下,最佳反应时间是10h
B. 4~10h内碳酸二甲酯的平均反应速率是7.5×10-4mol·L-1·h-1
C. 向反应体系中添加催化剂,一定能提高反应的TON
D. 该合成方法可以利用廉价的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面具有重要意义
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 56 g Fe 与1mol Cl2充分反应,转移的电子数为3NA
B. 分子数为 0.1NA的CH4和NH3混合气体,含有的共用电子对数为0.4NA
C. 25℃时,1L pH=12的Ba(OH)2溶液中含有0.02NA 的OH-
D. 常温常压下,22 g D3O+中含有10NA个电子
难度: 中等查看答案及解析
-
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.10 mol·L-1的NaOH溶液,整个过程中溶液pH变化的曲线如图所示。下列叙述中正确的是
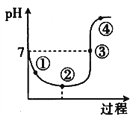
A. 点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)
B. 点②所示溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO)
C. 点③所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D. 点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
难度: 简单查看答案及解析
-
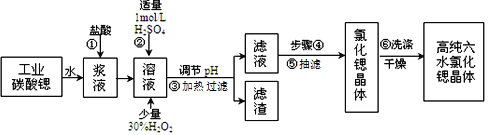
碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(含有质量分数为8%的TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下,(已知TeO2微溶于水,易溶于强酸和强碱),下列有关说法不正确的是
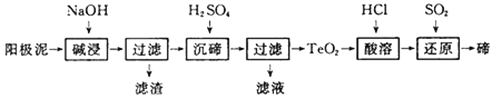
A. 将阳极泥研磨、反应适当加热都有利于提高“碱浸”的速率和效率
B. “碱浸”时发生主要反应的离子方程式为TeO2+2OH-=TeO32-+H2O
C. “沉碲”时为使碲元素沉淀充分,应加入过量的硫酸
D. 若提取过程碲元素的回收率为90%,则处理1kg这种阳极泥最少需通入标准状况下SO2 20.16L
难度: 中等查看答案及解析
-
某溶液中可能含有K+、Na+、Mg2+、NH4+、Fe2+、Br-、CO32-、SO42-、SO32-中的若干种离子,某同学做了如下实验:
① 取少量溶液,滴加足量氯水,有气泡产生且溶液颜色变成黄色
② 另取少量原溶液,滴加盐酸酸化的氯化钡溶液,无沉淀生成
③ 蘸取原溶液,做焰色反应,透过蓝色钴玻璃观察到火焰呈紫色。
为进一步确定该溶液的组成,无需进行的实验是
A. 上述实验③不透过蓝色钴玻璃观察火焰颜色
B. 取少量溶液,滴加氯水和CCl4,振荡、静置
C. 取少量溶液,滴加适量的稀硫酸和品红溶液
D. 取少量溶液,滴加适量的NaOH浓溶液,加热,用湿润的红色石蕊试纸检验气体
难度: 困难查看答案及解析
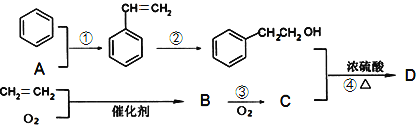
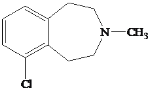 )是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成:
)是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成: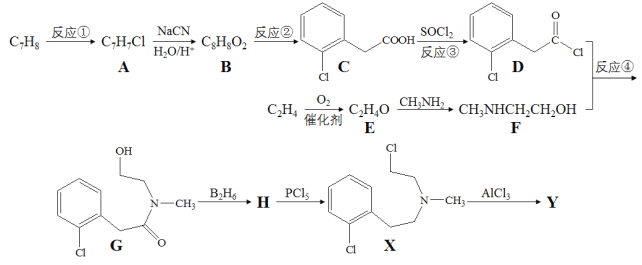
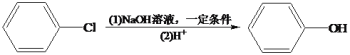
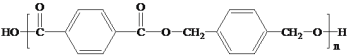 的线路图。___________
的线路图。___________