-
《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载。下列说法不正确的是
A. “薪柴之灰”可与铵态氮肥混合施用 B. “以灰淋汁”的操作是过滤
C. “取碱”得到的是一种盐溶液 D. “浣衣”过程有化学变化
难度: 中等查看答案及解析
-
下列叙述正确的是:
A. 使用催化剂可以改变反应的活化能,也可以改变反应的焓变。
B. 金属腐蚀分为析氢腐蚀和吸氧腐蚀
C. 电解饱和食盐水,阳极产物一定是氯气
D. 同种弱电解质溶液,增大物质的量浓度导电能力不一定增强
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是:
A. 铅蓄电池放电时,负极反应式为PbO2+4H++SO
+2e-===PbSO4+2H2O
B. 粗铜精炼时,与电源负极相连的是纯铜,阴极反应式为Cu2++2e-=== Cu
C. 生铁中含碳,抗腐蚀能力比纯铁强
D. 铁制品上镀锌,锌做阴极,铁制品做阳极,电解质溶液中含Zn2+
难度: 中等查看答案及解析
-
下列溶液一定呈酸性的是:
A. 含有H+的溶液 B. pH=6.5的溶液
C. c(OH-)<c(H+)的溶液 D. 常温下,由水电离的c(OH-)=1.0×10-13mol/L
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是
A. NaHS水解反应:HS-+H2O
H3O++S2-
B. Fe(OH)2与稀硝酸反应:2H++Fe(OH)2=Fe2++2H2O
C. 过量的SO2通入到漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3-
D. Na2CO3水溶液中存在平衡:CO32-+H2O
HCO3-+OH-
难度: 中等查看答案及解析
-
在铝与稀硫酸的反应中,已知10 s末硫酸的浓度减少了0.9 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸铝的平均反应速率是
A. 0.02 mol·L-1·min-1 B. 1.8 mol·L-1·min-1
C. 1.2 mol·L-1·min-1 D. 0.18 mol·L-1·min-1
难度: 简单查看答案及解析
-
室温下,下列离子组在给定条件下一定能大量共存的是:
A. pH=1的溶液中:K+、Na+、NO3-、CH3COO-
B. c(ClO-)=1.0mol/L 的溶液:K+、SO32-、S2-、Cl-
C. KCl溶液中:Na+、Fe3+、SO42-、SCN-
D. c(OH-)=1.0×10-13mol/L的溶液中:K+、Mg2+、Cl-、NO3-
难度: 中等查看答案及解析
-
下图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图,下列说法中不正确的是
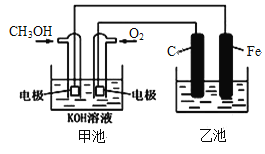
A. 甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
B. 若乙池中为足量AgNO3溶液,则阳极的电极反应为: 4OH--4e-= 2H2O+O2↑
C. 甲池中随着反应的不断进行,溶液的pH减小
D. 若乙池中为一定量CuSO4溶液,通电一段时间后,向溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA
难度: 中等查看答案及解析
-
已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是
A. AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B. AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C. 将0.001mol/LAgNO3溶液滴入0.001 mol/L的KCl溶液中,无沉淀析出
D. 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)< Ksp(AgBr)
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及解释或结论都正确且具有因果关系的是:
选项
操作
现象
解释或结论
A
测定等浓度的Na2SO3和NaHSO3溶液的pH
Na2SO3溶液的pH较大
HSO3-结合H+的能力比SO32-的强
B
向盛有2ml 0.1mol/L AgNO3溶液的试管中滴加一定量0.1mol/L NaCl溶液,再向其中滴加一定量 0.1mol/L KI溶液
先有白色沉淀生成,后又产生黄色沉淀
Ksp(AgCl)> Ksp(AgI)
C
室温下,取相同大小、形状和质量的Zn粒分别投入0.1mol/L的盐酸和1.0mol/L的盐酸中
Zn粒与1.0mol/L的反应更剧烈
探究浓度对化学反应速率的影响
D
用石墨做电极电解Mg(NO3)2、Cu(NO3)2的混合溶液
阴极上先析出铜
金属活动性:Cu > Mg
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向0.50 L 0.3mol·L-1NaOH溶液中缓慢通入CO2气体至溶液增重4.4g。有关该溶液说法正确的是
A. 溶质为Na2CO3
B. c(Na+)/2=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c(Na+)>c(CO32-)>c(HCO3-)>c(H+)>c(OH-)
D. c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
难度: 中等查看答案及解析
-
某弱酸溶液中存在电离平衡HA
H++A-,下列叙述不正确的是:
A. 溶液中离子浓度的关系满足:c(H+) = c(OH-)+c(A-)
B. 常温下,加入NaA固体可使HA的电离常数增大
C. HA溶液中加少量的NaA固体,平衡逆向移动
D. 0.10mol/L的HA溶液中加水稀释,溶液中c(OH-)增大
难度: 中等查看答案及解析
-
常温下,浓度均为0.1mol·L-1的四种溶液pH如下表,依据已有的知识和信息进行判断,下列说法正确的是
溶质
Na2CO3
NaClO
NaHCO3
NaHSO3
pH
11.6
10.3
9.7
4.0
A. 常温下,HSO3-的水解能力强于其电离能力
B. 向氯水中加入少量NaHCO3固体,不能增大HClO的浓度
C. Na2CO3 溶液中存在以下关系:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
D. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH依次升高
难度: 中等查看答案及解析
-
下列有关中和滴定的部分操作顺序正确的是:①标准溶液润洗滴定管②往滴定管中注入标准溶液③检查滴定管是否漏水④滴定⑤洗涤滴定管⑥调整滴定管中液面在“0”或“0”以下刻度⑦记数
A. ⑤①②③④⑥⑦ B. ③⑤①②⑥⑦④
C. ③⑤②⑦①⑥④ D. ②⑥⑦①③⑤④
难度: 中等查看答案及解析
-
常温下,向20mL0.2mol·L-1H2B溶液中滴加0.2mol·L-1NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ表示H2B,Ⅱ代表HB-、Ⅲ代表B2-),根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是
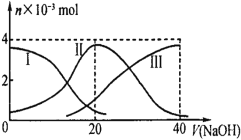
A. c(Na+)>c(HB-)>c(H+)>c(B2-)>c(H2B)
B. c(Na+)>c(HB-)>c(OH-)>c(H2B)>c(H+)>c(B2-)
C. c(Na+)>c(H+)>c(HB-)>c(B2-)>c(OH-)>c(H2B)
D. c(Na+)>c(OH-)>c(HB-)>c(H2B)>c(H+)>c(B2-)
难度: 中等查看答案及解析
-
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如右图所示。据图分析,下列判断错误的是
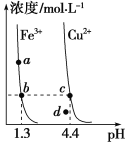
A. Ksp[Fe(OH)3]< Ksp [Cu(OH)2]
B. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
难度: 困难查看答案及解析