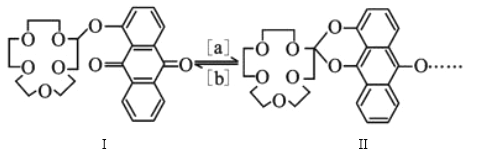
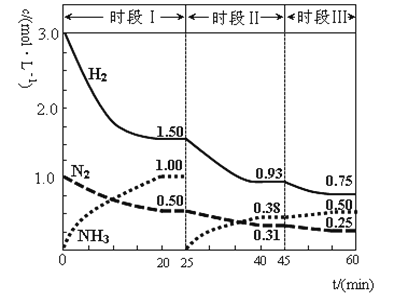
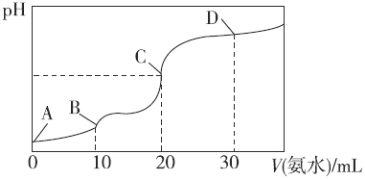
-
2018年是“2025中国制造”启动年,而化学与生活、人类生产、社会可持续发展密切相关,下列有关化学知识的说法错误的是
A. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B. 我国发射“嫦娥三号”卫星所使用的碳纤维是一种非金属材料
C. 用聚氯乙烯代替木材,生产快餐盒,以减少木材的使用
D. 碳纳米管表面积大,可用作新型储氢材料
难度: 简单查看答案及解析
-
下列家庭化学实验不能达到预期目的的是
A. 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
B. 用湿润的淀粉-KI 试纸检验 HCl气体中是否混有 Cl2
C. 向 Ca(ClO)2 溶液中加入硫酸溶液,来证明 S、Cl 的非金属性强弱
D. 将一片铝箔用火灼烧,铝箔熔化但不滴落,证明铝箔表面致密Al2O3薄膜熔点高于Al
难度: 中等查看答案及解析
-
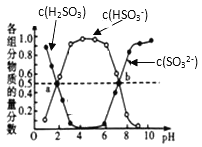
下列表示对应化学反应的离子方程式正确的是( )
A. 氢氧化铁胶体中加入HI溶液:Fe(OH)3+3H+═Fe3++3H2O
B. 用氨水溶解氢氧化铜沉淀:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O
C. 用稀硝酸除去试管内壁银:3Ag+4H++NO3﹣═3Ag++NO↑+2H2O
D. 向NaClO溶液中通入过量的SO2:SO2+NaClO+H2O=HClO+NaHSO3
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言描述,下列有关化学用语表示正确的是
A. 碳铵的化学式:NH4HCO3
B. 次氯酸的结构式:H—C1—O
C. 中子数为145、质子数为94的钚(Pu)原子:
D. S2-的结构示意图:
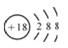
难度: 中等查看答案及解析
-
下列实验装置设计不能达到目的的是
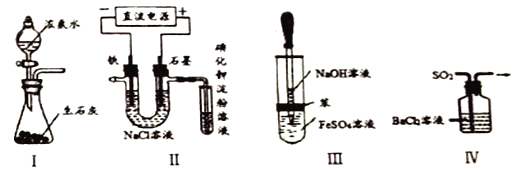
A. 实验I:所示装置可制备氨气 B. 实验Ⅱ:检验电解饱和食盐水的产物Cl2
C. 实验Ⅲ:制取并观察Fe(OH)2沉淀 D. 实验IV:吸收SO2
难度: 困难查看答案及解析
-
A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍。A、B、C三种元素的单质在适当条件下可发生如图所示的变化。下列说法不正确的是
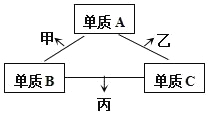
A. 甲、乙、丙三种物质的水溶液均显碱性
B. 原子半径:r(A)<r(C)<r(B)
C. 甲、乙可能都具有漂白性
D. 丙的水溶液在空气中长期放置,溶液可能会变浑浊
难度: 困难查看答案及解析
-
给定条件下,下列选项中所示的物质间转化均能一步实现的组合是
① FeS2
SO2
H2SO4
② SiO2
SiCl4
Si
③ Al
NaAlO2(aq)
NaAlO2(s)
④ 1 mol·L−1HCl(aq)
Cl2
Ca(ClO)2
⑤ CuSO4(aq)
Cu(OH)2
CuO
⑥ 饱和NaCl溶液
NaHCO3
Na2CO3
A. ①③⑤ B. ①③⑥
C. ②③④ D. ①④⑥
难度: 简单查看答案及解析
-
如图是金属镁和卤素单质(X2)反应的能量变化示意图。
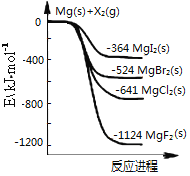
下列说法正确的是
A. 卤素单质(X2)与水反应均可生成两种酸
B. 用电子式表示MgF2的形成过程为:
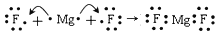
C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g),ΔH=-277kJ·mol-1
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是
A. 无色透明的溶液中:Ba2+、K+、HCO3-、NO3-
B. 水电离出的c(H+)= 1×10-13 mol·L-1的溶液中:Ca2+、Ba2+、Cl-、HCO3-
C. 加入铝粉能放出氢气的溶液中:Ba2+、Cl-、Fe3+、NO3-
D. c(SO32-)=0.1 mol·L-1的溶液中:Ca2+、MnO4-、SO42-、H+
难度: 中等查看答案及解析
-
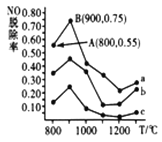
当1,3-丁二烯和溴单质1∶1加成时,其反应机理及能量变化如下:

不同反应条件下,经过相同时间测得生成物组成如下表:
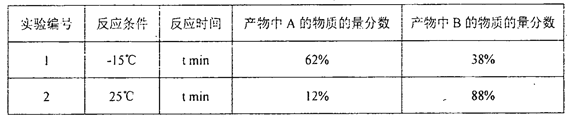
下列分析不合理的是
A. 产物A、B互为同分异构体,由中间体生成A、B的反应互相竞争
B. 相同条件下由活性中间体C生成产物A的速率更快
C. 实验1测定产物组成时,体系己达平衡状态
D. 实验1在tmin时,若升高温度至25℃,部分产物A会转化成产物B
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作与现象
结论
A
将 Fe(NO3)2 溶于稀 H2SO4 后,滴加 KSCN 溶液,溶液变成红色
Fe(NO3)2 中一定含 Fe3+
B
从煤油中取出一小块钠,用滤纸擦净表面的煤油,
放入无水乙醇中,产生气泡
Na 能置换出烃基中的氢
C
向某钠盐 X 的溶液中先滴加稀盐酸,无现象,再滴加 BaCl2 溶液,出现白色沉淀
X 不一定是 Na2SO4
D
向鸡蛋清溶液中加入少量 CuSO4 溶液,出现浑浊
蛋白质发生了盐析
A. A B. B C. C D. D
难度: 中等查看答案及解析