-
卤素单质从F2到I2,在常温、常压下的聚集状态由气态、液态到固态的原因是 ( )
A. 原子间的化学键键能逐渐减小
B. 范德华力逐渐增大
C. 原子半径逐渐增大
D. 氧化性逐渐减弱
难度: 简单查看答案及解析
-
前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有
A. 3种 B. 4种 C. 5种 D. 6种
难度: 简单查看答案及解析
-
在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
A.Li,F B.Na,F C.Na,C1 D.Mg,O
难度: 中等查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法,不正确的是
A. NH5中既有离子键又有共价键 B. NH5的熔沸点高于NH3
C. 1mol NH5中含有5molN—H键 D. NH5固体投入少量水中,可产生两种气体
难度: 中等查看答案及解析
-
第N能层所含能级数、原子轨道数分别是
A. 2、9 B. 4、12 C. 5、16 D. 4、16
难度: 简单查看答案及解析
-
在d轨道中电子排布成
 ,而不能排布成
,而不能排布成 ,其最直接的根据是( )
,其最直接的根据是( )A. 能量最低原理 B. 泡利原理 C. 原子轨道构造原理 D. 洪特规则
难度: 中等查看答案及解析
-
外围电子排布式为4f75d16s2的元素在周期表中的位置应是
A. 第四周期第ⅦB族 B. 第五周期第ⅢB族 C. 第六周期第ⅦB族 D. 第六周期第ⅢB族
难度: 中等查看答案及解析
-
下表中是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是
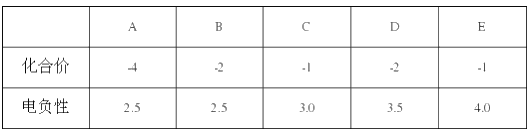
A. C、D、E 的氢化物的稳定性:C>D>E
B. 元素 A 的原子最外层轨道中无自旋状态相同的电子
C. 元素 C、D 之间不可能形成化合物
D. 与元素 B 同周期且第一电离能最小的元素的单质能与 H2O 发生置换反应
难度: 中等查看答案及解析
-
A与B两元素的阴离子具有相同的电子层结构,A元素的阴离子半径小于B元素的阴离子半 径,A和C两元素的原子最外层电子排布相同,C元素的第一电离能大于A元素的第一电离能,则A、B、C的原子序数为
A. B>A>C B. C>B>A C. A>B>C D. C>A>B
难度: 中等查看答案及解析
-
用价层电子对互斥理论预测PCl3和CO32-的空间构型,结论正确的是
A. 直线形;三角锥形 B. 三角锥形;平面三角形
C. V形;三角锥形 D. 直线形;平面三角
难度: 中等查看答案及解析
-
工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
已知:①Ni2+在弱酸性溶液中发生水解②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
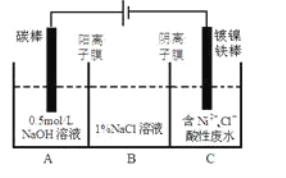
A. 碳棒上发生的电极反应:4OH--4e-==O2↑+2H2O
B. 电解过程中,B室中NaCl的物质的量浓度将不断减小
C. 为了提高Ni的产率,电解过程中需要控制废水的pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
难度: 中等查看答案及解析
-
下列有关电离能的说法中正确的是
A. 对于同一元素而言,原子的电离能I1>I2>I3…
B. 钾比钠活泼,所以钾的第一电离能大于钠的第一电离能
C. 同一周期中,主族元素原子第一电离能从左到右越来越大
D. 可通过一种元素各级电离能的数值,判断元素可能的化合价
难度: 中等查看答案及解析
-
已知:①C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H1=-Q1kJ·mol-1
②C2H5OH(g)=C2H5OH(l) △H2=-Q2kJ·mol-1
③H2O(g)=H2O(l) △H3=-Q3kJ·mol-1
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为(kJ)
A. Q1+ Q2+Q3 B. 0.5Q1-0.5Q2+1.5Q3
C. 0.5(Q1+ Q2+Q3 ) D. 0.5Q1-1.5Q2+0.5Q3
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 在气体单质分子中,一定含有σ键,可能含有π键
B. 烯烃比烷烃的化学性质活泼是由于烷烃中只含σ键而烯烃含有π键
C. 等电子体结构相似,化学性质相同
D. 共价键的方向性决定了原子在形成分子时相互结合的数量关系
难度: 中等查看答案及解析
-
W、Q、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外 层电子数之和为21。下列说法不正确的是

A. Q的原子半径比Y的大
B. Z的氧化物的水化物的酸性比WW的强
C. Y的氢化物可能具有强氧化性
D. Q与W或Y形成的化学键类型相同
难度: 中等查看答案及解析
-
下列物质中属于含有极性键的非极性分子的是
A. CS2 B. H2O C. CH3Cl D. NH3
难度: 中等查看答案及解析
-
下列现象与氢键有关的是
①NH3的熔,沸点比PH3的高
②乙醇能与水以任意比混溶,而甲醚(CH3- O-CH3)难溶于水
③冰的密度比液态水的密度小
④邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑤水分子高温下也很稳定.
A. ①②③④ B. ①②③⑤ C. ②③④⑤ D. ①④⑤
难度: 中等查看答案及解析
-
室温下将浓度相等的NaOH和HCl溶液以3:2的体积比混合,所得溶液的pH=12,则原溶液的浓度是
A. 0.01mol/L B. 0.017 mol/L C. 0.05mol/L D. 0.50 mol/L
难度: 中等查看答案及解析
-
下列溶液中,粒子浓度关系不正确的是
A. 在常温下,向0.01 mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B. 25℃时,在0.1mol•L-1的NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-)
C. 浓度均为0.1mol•L-1的HF溶液和KF溶液等体积混合:c(F-)+c(HF)=0.2mol/L
D. 均为0.1mol•L-1的Na2S溶液和NaHS溶液等体积混合:2c(Na+)=3c(HS-)+3c(H2S)+3c(S2-)
难度: 困难查看答案及解析
-
某物质A的实验式为CoCl3·4NH3,1molA中加入足量的AgNO3溶液中能生成1mol白色沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是
A. Co3+只与NH3形成配位键
B. 配合物配位数为3
C. 该配合物可能是平面正方形结构
D. 此配合物可写成[Co(NH3)4 Cl2] Cl
难度: 中等查看答案及解析
-
已知Ksp(Mg(OH)2)=1.8×10-11,则:Mg(OH)2在水中的溶解的浓度为
A. 2.6×10-4mol/L B. 1.7×10-4mol/L C. 4.2×10-6mol/L D. 3.2×10-22mol/L
难度: 中等查看答案及解析
-
带静电的有机玻璃靠近下列液体的细流时,细流会发生偏转的是:
A. CS2 B. 液溴 C. CCl4 D. H2O
难度: 中等查看答案及解析
-
已知298.15K时,可逆反应:Pb2+(aq)+Sn(s)
Pb(s)+Sn2+(aq)的平衡常数K=2.2,若溶液中Pb2+和Sn2+的浓度均为0.010mol·L-1,则反应进行的方向是
A. 向右进行 B. 向左进行 C. 处于平衡状态 D. 无法判断
难度: 中等查看答案及解析
-
化学与生产、生活密切相关,下列应用与盐类的水解无关的是
A. 实验室盛放碳酸钠溶液的试剂瓶不能用玻璃塞
B. 配制氯化铁溶液时,将氯化铁先溶于盐酸,再加水稀释
C. 氯化铵溶液可用于除铁锈
D. 可用饱和氯化钠溶液除去氮气中的HC1气体
难度: 中等查看答案及解析
-
根据相似相溶规则和实际经验,下列叙述不正确的是
A. 白磷(P4)易溶于CS2,但难溶于水 B. NaCl易溶于水,难溶于CCl4
C. 碘易溶于苯,微溶于水 D. 卤化氢易溶于水,也易溶于CCl4
难度: 简单查看答案及解析
-
可以充分说明反应P(g)+Q(g)
R(g)+S(g)在恒温下以达到平衡的是
A. 反应容器内P、Q、R、S的浓度不随时间改变
B. 反应容器内P、Q、R、S四者共存
C. P的生成速率和S的生成速率相等
D. 容器内气体总物质的量不随时间变化
难度: 中等查看答案及解析
-
下列说法正确的是
A. 由电负性数值:铍—1.5;氯—3.0可推知氯化氨中是离子键
B. 根据对角线规可知Li在空气中燃烧会生成Li3N和Li2O
C. H—O键能为QkJ/mol,则1molH2分解生成和O2需要吸收2QkJ能量
D. 稀有气体一般很难参与反应,是因为其分子内的键能很大,很难断裂
难度: 中等查看答案及解析
-
在一密闭容器中有如下反应:aX(g)+bY(g)
nW(g).某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
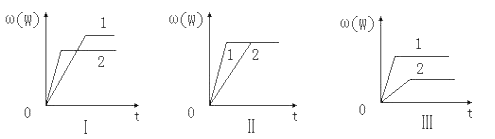
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间.当其它条件不变时,下列分析正确的是
A. 图Ⅰ可能是不同压强对反应的影响,且p2>p1,a+b<n
B. 图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b
C. 图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
D. 图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0
难度: 困难查看答案及解析