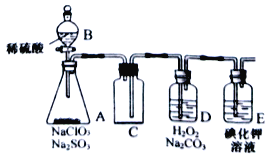
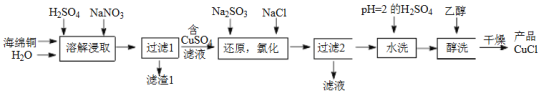
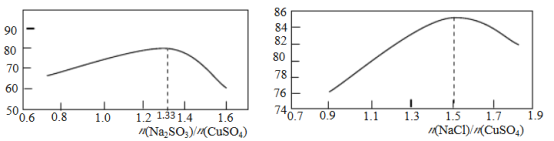
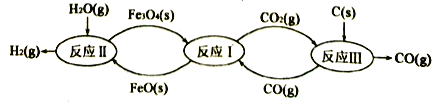
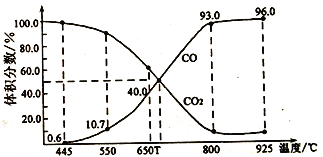
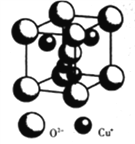
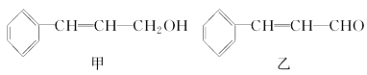
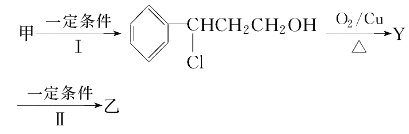
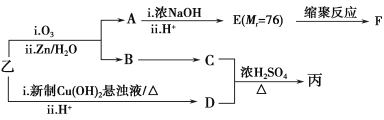
-
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列有关叙述错误的是
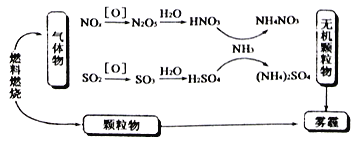
A. 雾和霾的分散质不同分散剂相同 B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂 D. 雾霾的形成与过度施用氮肥有关
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关说法中正确的有
①1L0.1 mol·L-1 FeCl3溶液中含Fe3+数目为0.1NA
②5.6g铁粉与3.2g硫粉混合隔绝空气加热,充分反应后,转移电子数为0.2NA
③0.lmol乙醇与0.lmol乙酸在浓硫酸催化并加热下,生成乙酸乙酯分子数为0.1NA
④60gSiO2中含有的Si-O键和12g金刚石中含有的C-C键的数目均为NA
⑤体积为11.2L的氯气中含有氯原子数约为6.02×1025个
⑥92g的NO2和N2O4混合气体含有的原子数为6NA
⑦10g46%甲酸( HCOOH)水溶液中所含的氧原子数为0.5NA
⑧7.8gNa2O2与足量的水(H218O)反应生成的氧气中所含的中子数为0.5NA
A. 四种 B. 三种 C. 五种 D. 两种
难度: 中等查看答案及解析
-
已知X、Y、Z、W四种元素分别是元素周期表中三个连续短周期的主族元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素,W原子的质子数等于Y、Z原子的最外层电子数之和。下列有关说法正确的是
A. Y、Z分别与Ⅹ形成化合物的稳定性前者大于后者
B. 由以上元素两两形成的化合物中,溶于水显碱性的只有两种
C. 由X、Y、Z三种元素所形成的化合物只含共价键
D. Z、W所形成的简单离子半径前者比后者大
难度: 困难查看答案及解析
-
网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构。下列有关辛酸的叙述正确的是

A. 辛酸的同分异构体中能水解生成乙醇的酯类同分异构体共有8种
B. 辛酸的同分异构体(CH3)3CCH(CH3)CH2COOH的名称为2,2,3——三甲基戊酸
C. 辛酸和油酸(C17H33COOH)都是一元羧酸,故二者属于同系物
D. 1mol辛酸与足量的Na反应产生11.2LH2
难度: 困难查看答案及解析
-
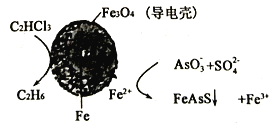
实验室可利用硫酸厂炉渣(主要成分为铁的氧化物,还含有少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式为[Fe2( OH)n( SO4)3-0.5n]m,制备过程如图所示。下列说法不正确的是
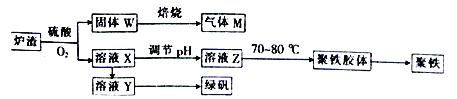
A. 炉渣中FeS与硫酸、氧气反应的离子方程式为4FeS+3O2+12H+=4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C. 若调节溶液Z的pH偏小,则将导致聚铁中铁的质量分数偏大
D. 溶液X转化为溶液Y需要加过量铁粉,再过滤
难度: 困难查看答案及解析
-
已知电极上每通过96500 C的电量就会有1 mol电子发生转移。精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量。实际测量中,常用银电量计,如图所示。下列说法不正确的是
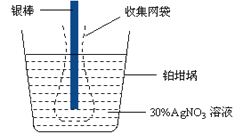
A. 若要测定电解饱和食盐水时通过的电量,可将该银电量计中的银棒与待测电解池的阳极相连,铂坩埚与电源的负极相连。
B. 称量电解前后铂坩埚的质量变化,得金属银的沉积量为108.0 mg,则电解过程中通过电解池的电量为96.5 C
C. 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋。若没有收集网袋,测量结果会偏高。
D. 电量计中的银棒应与电源的正极相连,铂坩埚上生的电极反应是:Ag+ + e- = Ag
难度: 中等查看答案及解析
-
常温下,向20.00mL0.1mol·L-1KOH溶液中滴加0.1 mol·L -1HA(弱酸)溶液,混合溶液中水电离出的c(OH-)与HA溶液体积之间的关系如图I所示:向20.00mL0.1 mol ·L-1 HA溶液中滴加0. 1mol ·L-1 KOH溶液,混合溶液中水电离出的c(OH-)与KOH溶液体积之间的关系如图II所示。
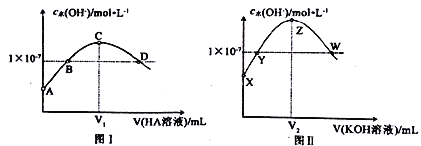
下列有关说法正确的是
A. A点、X点对应溶液中水的电离程度相同
B. B点、Y点对应溶液的pH相等
C. C点、Z点对应溶液中都存在:c(OH-)=c(H+)+c(HA)
D. D点、W点对应溶液中分别都存在:c(K+)=c(A-)
难度: 困难查看答案及解析