-
中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鍮石(即鍮石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O)和木炭粉混合加热至800℃左右可制得与黄金相似的鍮石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为________________,铜元素基态原子中的未成对电子数为_________________。
(2)硫酸锌溶于过量氨水形成[ Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是__________________,[Zn(NH3)4]2+中含有的化学键有__________________。
②NH3分子中,中心原子的轨道杂化类型为________________,NH3在H2O中的溶解度____________(填“大”或“小”),原因是_____________________。
(3)铜的第一电离能为I1Cu=745.5kJ·mol-1,第二电离能为I2Cu=1957.9kJ·mol-1,锌的第一电离能为I1Zn=906.4kJ·mol-1,第二电离能为I2Zn=1733.3kJ·mol-1,I2Cu>I2Zn的原因是___________________。
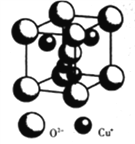
(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为_______________;若Cu2O的密度为dg·cm-3,则晶胞参数a=____________nm。

-
中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鍮石(即鍮石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O)和木炭粉混合加热至800℃左右可制得与黄金相似的鍮石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为________________,铜元素基态原子中的未成对电子数为_________________。
(2)硫酸锌溶于过量氨水形成[ Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是__________________,[Zn(NH3)4]2+中含有的化学键有__________________。
②NH3分子中,中心原子的轨道杂化类型为________________,NH3在H2O中的溶解度____________(填“大”或“小”),原因是_____________________。
(3)铜的第一电离能为I1Cu=745.5kJ·mol-1,第二电离能为I2Cu=1957.9kJ·mol-1,锌的第一电离能为I1Zn=906.4kJ·mol-1,第二电离能为I2Zn=1733.3kJ·mol-1,I2Cu>I2Zn的原因是___________________。
(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为_______________;若Cu2O的密度为dg·cm-3,则晶胞参数a=____________nm。
-
中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鑰石(即石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O和木炭粉混合加热至800℃左右可制得与黄金相似的输石金。回答下列问题:
(1)锌元素基态原子的价电子排布式为___________,铜元素基态原子中的未成对电子数为___________。
(2)硫酸锌溶于过量氨水形成[Zn(NH3)]SO4溶液。
①[Zn(NH3)4]SO4中,阴离子的立体构型是___________, [Zn(NH3)4]2+中含有的化学键有_______。
②NH3分子中,中心原子的轨道杂化类型为___________, NH3在H2O中的溶解度___________(填“大”或“小”),原因是_________________________________。
(3)铜的第一电离能为I1(Cu)=745.5 kJ·mol-1,第二电离能为l2(Cu)=1957.9 kJ·mol-1,锌的第一电离能为I1(Zn)=906.4 kJ·mol-1,第二电离能为I2(Zn)=1733.3kJ·mo1-1,I2(Cu)>I2(Zn)的原因是_______________

(4)Cu2O晶体的晶胞结构如图所示。O2-的配位数为___________;若Cu2O的密度为dg·cm-3,则晶胞参数a=___________nm。
-
运用现代化学的知识对我国古代的相关工艺进行分析,不正确的是( )
A. 用粘土焙烧制得的红陶,陶器显红色的原因可能是含有Fe2O3、Cu2O等
B. 用炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭混合加热制得的合金称为“鍮”,它难溶于硝酸
C. 用明矾溶液清除铜镜表面的铜锈,利用了明矾溶液的酸性
D. 制指南针的磁石主要成分是四氧化三铁
-
我国古代“药金”的冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A. “药金”实质上是铜锌合金
B. 冶炼炉中炉甘石直接被木炭还原为锌
C. 用王水可区别黄金和“药金”
D. 用火焰灼烧不能区别黄金和药金
-
将炉甘石(ZnCO3)、赤铜矿(Cu2O)和过量的炭混合后,加热至800℃左右,即得金光闪闪的“假黄金”。有同学对“假黄金”的组成进行了以下探究。
[查阅资料]高温时炭可将金属活动顺序表中铝以后的金属氧化物还原成金属单质;ZnCO3高温可分解成金属氧化物。
[提出问题]“假黄金”的化学组成可能是什么?
[猜想]甲同学对该“假黄金”的组成作了以下三种猜想:
猜想1)可能的单质有:C、Zn、Cu
猜想2)可能的氧化物有:ZnO、CuO、Cu2O
猜想3)可能是单质和氧化物组成的混合物
[论证]乙同学经思考和推理后,首先排除了猜想________(选填①②或③),理由是________。
进而再排除了猜想________(选填①②或③);对余下的一种猜想,乙同学又排除了其中的一种物质,依据是________。对余下的两种物质,甲和乙同学用实验鉴定该两种物质确实是“假黄金”的成分。
-
据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来冶炼倭铅(即锌),其原理如图2。已知锌的熔点420℃、沸点906℃。则下列说法错误的是( )

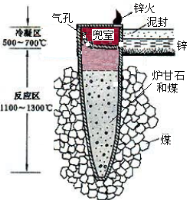
图1 图2
A.“泥封”的目的是为了防止得到的锌被氧化
B.“锌火”是锌蒸气和一氧化碳在空气的燃烧
C.冶炼时锌变为蒸气在兜室冷凝为固体
D.升炼倭铅过程包含分解反应和氧化还原反应
-
明代宋应星所著《天工开物》中己经记载了我国古代用炉甘石(主要成分ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:
(1) Zn原子基态核外电子排布式为___________________。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①SO42-中心原子的轨道杂化类型为_____,与它互为等电子体的阴离子化学式为____(写出一种)。
②在[Zn(NH3)4]2+中Zn2+与NH3之间形成的化学键为___,提供孤电子对的成键原子是____。 ③氨的热稳定性强于膦(PH3),原因是_______。
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为:ICu=746kJ/mol,Izn=906 kJ/mol,ICu < Izn的原因是_____________。
(4)《本草纲自》中记载炉甘石(主要成分ZnCO3)可止血,消肿毒,生肌,明目……。
Zn、C、O电负性由大至小的顺序是________。ZnCO3中阴离子的立体构型是______。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶胞结构如图所示,每个Zn原子周围最近的Zn原子数目为____________。
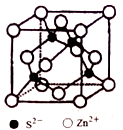
晶胞边长为a pm,阿伏加德罗常数为NA,则ZnS晶体的密度为_____g/cm3 (列出计算式即可)
-
明代宋应星所著《天工开物》中已经记载了我国古代用炉甘石(主要成分ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:
(1)Zn原子基态核外电子排布式为_____________________________。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①与SO42-互为等电子体的阴离子化学式为________________(写出一种)
②氨的热稳定性强于膦(PH3),原因是____________________________。
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为ICu=746 kJ·mol-1,IZn=906 kJ·mol-1,ICu< IZn的原因是___________________。
(4)《本草纲目》中记载炉甘石(主要成分ZnCO3)可止血,消肿毒,生肌,明目……。Zn、C、O电负性由大至小的顺序是_________________。ZnCO3中阴离子的立体构型是_____________________。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶胞结构如图所示,每个Zn原子周围最近的Zn原子数目为________________。晶胞边长为apm,阿伏加德罗常数的值为NA,则ZnS晶体的密度为 __________g·cm-3(列出计算式即可)。

-
我国是最早发现并使用锌的国家,《天工开物》记载了炉甘石(ZnCO3)和木炭冶炼锌。现代工业上用氧化锌烟灰(主要成分为ZnO 、少量Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。
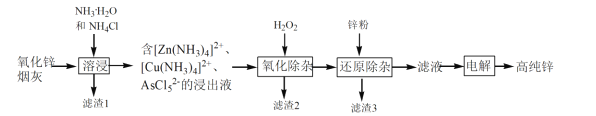
请回答下列问题:
(1)《天工开物》中炼锌的方法中利用了木炭的____ 性。
(2)滤渣1和滤渣3的主要成份分别是______、______(填化学式)。
(3)“溶浸”时,氧化锌参与反应的相关离子方程式是______;“溶浸”时温度不宜过高,其原因是______。
(4)“氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,该反应的离子方程式是______。
(5)“电解”含 [Zn(NH3)4]2+的溶液,阴极放电的电极反应式是______。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是_____(写化学式)。该流程中可以循环使用的物质是_____(写化学式)。







