-
(1)铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,反应Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g),阻碍循环反应的进行。
3Fe(s)+4CO2(g),阻碍循环反应的进行。
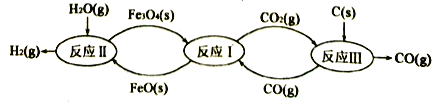
已知:i. Fe3O4(s)+CO(g) 3FeO(s)+CO2(g);△H1=+19.3 kJ·mol-1
3FeO(s)+CO2(g);△H1=+19.3 kJ·mol-1
ii. 3FeO(s)+H2O(g) Fe3O4(s)+H2(g);△H2=-57.2 kJ·mol-1
Fe3O4(s)+H2(g);△H2=-57.2 kJ·mol-1
iii. C(s)+CO2(g) 2CO(g);△H3=+172.4 k]·mol-1
2CO(g);△H3=+172.4 k]·mol-1
铁氧化物循环裂解水制氢气总反应的热化学方程式是___________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和炭粉,发生反应Fe2O3(s)+3C(s) 2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是___________(填写字母)。
2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是___________(填写字母)。
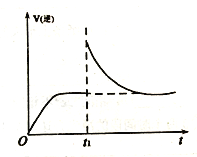
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
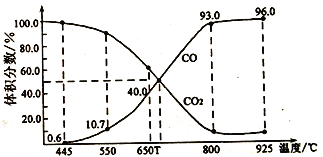
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2与足量的碳,发生反应,平衡时体系中气体体积分数与温度的关系如图所示
①650℃时,该反应达平衡后吸收的热量是___________。
②T℃时,若向平衡体系中再充入一定量按V(CO2)︰V(CO)=5︰4的混合气体,平衡___________(填“正向”、“逆向”或“不”)移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为___________。[气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如下图所示(导电壳内部为纳米零价铁)
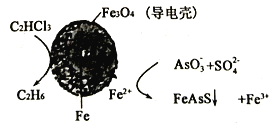
在除污过程中,纳米零价铁中的Fe为原电池的___________极(填“正”或“负”),写出C2HCl3在其表面转化为乙烷的电极反应式为___________。
(5)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制100mL5mol·L-1FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2mol·L-1的盐酸_________mL(忽略加入盐酸体积)。
-
铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。由此产生的 等废气处理意义重大。
等废气处理意义重大。
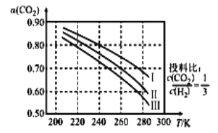
(1)将 应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为
应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为 。如图为
。如图为 平衡转化率和温度、压强的关系,其中压强分别为
平衡转化率和温度、压强的关系,其中压强分别为 。据图可知,该反应为_______反应(填“吸热”或“放热”)。设
。据图可知,该反应为_______反应(填“吸热”或“放热”)。设 的初始浓度为
的初始浓度为 ,根据
,根据 时的数据计算该反应的平衡常数
时的数据计算该反应的平衡常数 _________(列式即可)。若4.0Mpa时减小投料比
_________(列式即可)。若4.0Mpa时减小投料比 ,则
,则 的平衡转化率曲线可能位于II线的_________(填“上方”或“下方”)。
的平衡转化率曲线可能位于II线的_________(填“上方”或“下方”)。
(2) 时,向某恒温密闭容器中加入一定量的
时,向某恒温密闭容器中加入一定量的 和
和 ,发生反应
,发生反应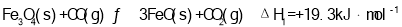 ,反应达到平衡后,在
,反应达到平衡后,在 时刻,改变某条件,
时刻,改变某条件, 随时间(t)的变化关系如图1所示,则
随时间(t)的变化关系如图1所示,则 时刻改变的条件可能是______(填写字母)。
时刻改变的条件可能是______(填写字母)。
a 保持温度不变,压缩容器 b 保持体积不变,升高温度
c 保持体积不变,加少量碳粉 d 保持体积不变,增大 浓度
浓度
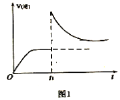
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2与足量的碳,发生反应 ,平衡时体系中气体体积分数与温度的关系如图2所示,①650℃时,该反应达平衡后吸收的热量是___________KJ。②T℃时,若向平衡体系中再充入
,平衡时体系中气体体积分数与温度的关系如图2所示,①650℃时,该反应达平衡后吸收的热量是___________KJ。②T℃时,若向平衡体系中再充入 的混合气体,平衡_______________(填“正向”、“逆向”或“不”)移动。
的混合气体,平衡_______________(填“正向”、“逆向”或“不”)移动。
(4)已知25℃时, ,此温度下若在实验室中配制100mL 5 mol∙L−1FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2 mol∙L−1的盐酸___________mL(忽略加入盐酸体积)。
,此温度下若在实验室中配制100mL 5 mol∙L−1FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2 mol∙L−1的盐酸___________mL(忽略加入盐酸体积)。
-
铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。由此产生的CO2、SO2等废气处理意义重大。
(1)将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为CO2(g)+3H2(g)→CH3OH(g)+H2O(g)。如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa、5.0MPa。据图可知,该反应为____反应(填“吸热”或“放热”)。
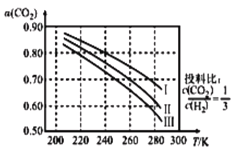
设CO2的初始浓度为c0mol•L-1,根据5.0MPa时的数据计算该反应的平衡常数K(240)=_____(列式即可)。若4.0Mpa时减小投料比c(CO2):c(H2),则CO2的平衡转化率曲线可能位于II线的____(填“上方”或“下方”)。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe3O4和CO,发生反应Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) △H1=+19.3kJ•mol-1,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
3FeO(s)+CO2(g) △H1=+19.3kJ•mol-1,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
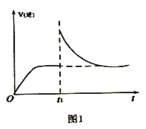
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO2浓度
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2与足量的碳,发生反应C(s)+CO2(g) 2CO(g) △H3=+172.4kJ•mol-1,平衡时体系中气体体积分数与温度的关系如图2所示:
2CO(g) △H3=+172.4kJ•mol-1,平衡时体系中气体体积分数与温度的关系如图2所示:
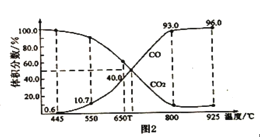
①650℃时,该反应达平衡后吸收的热量是____kJ。
②T℃时,若向平衡体系中再充入V(CO2):V(CO)=4:5的混合气体,平衡____(填“正向”、“逆向”或“不”)移动。
(4)已知25℃时,Ksp[Fe(OH)3]=4.0×10﹣38,此温度下若在实验室中配制100mL5mol•L-1FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2mol•L-1的盐酸____ mL(忽略加入盐酸体积)。
-
铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
| 反应 | △H(kJ/mol) | K |
| i. Fe2O3(s)+3C(s)  2Fe(s)+3CO(g) 2Fe(s)+3CO(g) | +489 | K1 |
| ii. Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) 2Fe(s)+3CO2(g) | X | K2 |
| iii. C(s)+CO2(g)  2CO(g) 2CO(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为____________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
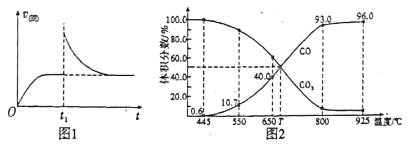
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是______。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示( 导电壳内部为纳米零价铁)。
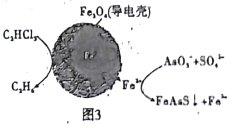
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。
-
铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
| 反应 | △H(kJ/mol) | K |
| i. Fe2O3(s)+3C(s)  2Fe(s)+3CO(g) 2Fe(s)+3CO(g) | +489 | K1 |
| ii. Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) 2Fe(s)+3CO2(g) | X | K2 |
| iii. C(s)+CO2(g)  2CO(g) 2CO(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为K1=__________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
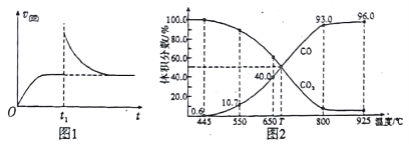
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是_________。
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如下图所示( 导电壳内部为纳米零价铁)。
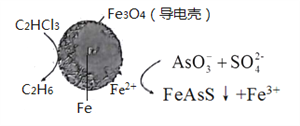
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。
-
铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
| 反应 | △H(kJ/mol) | K |
| i. Fe2O3(s)+3C(s)  2Fe(s)+3CO(g) 2Fe(s)+3CO(g) | +489 | K1 |
| ii. Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) 2Fe(s)+3CO2(g) | X | K2 |
| iii. C(s)+CO2(g)  2CO(g) 2CO(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为____________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
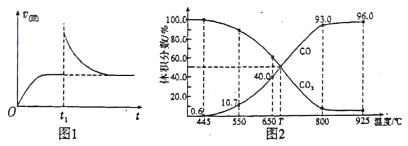
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是______。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示( 导电壳内部为纳米零价铁)。

在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。
-
铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
| 反应 | △H(kJ/mol) | K |
| i. Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) 2Fe(s)+3CO(g) | +489 | K1 |
| ii. Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) 2Fe(s)+3CO2(g) | X | k2 |
| iii. C(s)+CO2(g) 2CO(g) 2CO(g) | +172 | k3 |
试计算,X=____,K1 、K2与K3之间的关系为__________________。
(2) T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_______ (填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持温度体积不变,增大CO浓度
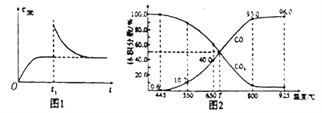
(3)在一定温度下, 向某体积可变的恒压密闭容器(P 总)加入1molCO2与足最的碳,发生反应iii,平衡时体系中气体体积分数与温度的关系如图2所示。
①650℃时,该反应达平衡后吸收的热量是__________。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按v(CO2):V(CO)=5:4的混合气体,平衡______(填“正向”、”逆向”或“不”)移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压化替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示(导电壳内部为纳米零价铁)。

在除污过程中,纳米零价铁中的Fe为原电池的____极 (填“正”或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为____________________。
(5)NaHS可用于污水处理的沉淀剂。已知: 25℃时,反应Hg2+(aq)+HS-(aq)  HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。
②Ksp(HgS)=_______________。
-
金属单质及其化合物在生产生活中应用非常广泛,废旧金属的回收利用是重要研究课题。某学习小组在实验室中模拟利用含铜废料(主要成分为Cu和CuO,还有少量的A1,Fe及其氧化物)生产胆矾,其实验方案如下:

(1)上述流程中,操作1所得“滤液”的主要成分为_____________;
(2)酸溶后所得溶液中的溶质主要有_____________;
(3)请写出酸溶过程单质铜发生反应的离子方程式___________;该反应中氧化剂与还原剂的物质的量之比为______________;
(4)试剂可以是________________;
(5)操作3是一系列操作.其操作为______________、冷却结晶、过滤、___________、小心干燥。
-
锌及其化合物在生产生活中应用比较广泛。
(1)ZnFe2O4是一种性能优良的软磁材料,也是一种催化剂,能催化烯类有机物氧化脱氢等反应。
①ZnFe2O4中Fe的化合价是___________。
②工业上利用反应ZnFe2(C2O4)3·6H2O ZnFe2O4+2CO2↑+4CO↑+6H2O 制备ZnFe2O4该反应中还原产物是___(填化学式),每生成1mol ZnFe2O4转移的电子总数是__________。
ZnFe2O4+2CO2↑+4CO↑+6H2O 制备ZnFe2O4该反应中还原产物是___(填化学式),每生成1mol ZnFe2O4转移的电子总数是__________。
(2)工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:

①酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可采用的措施是_______(任答一条)。写出ZnFe2O4溶于酸的离子方程式__________。
②净化I中H2O2 参与反应的离子方程式为___________
③净化Ⅱ中Y 的主要成分是_____(填化学式)。
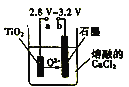
(3)利用锌锰电池在800~1000℃时电解TiO2可制得金属钛,装置如图所示。图中a电极的材料为_____,阴极的电极反应式为___________。
-
在生产生活中氮及其化合物的应用和处理已引起广泛关注。
(1)合成氨的反应原理为N2(g)+3H2(g) 2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是________,则该条件下反应的平衡常数为________。
2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是________,则该条件下反应的平衡常数为________。

A.活塞不再移动 B.容器内气体压强不再改变
C.容器内气体密度不再改变 D.容器内气体的平均分子质量不再改变
(2)研究者通过探索,发现利用反向燃料电池可以在温和的条件下将电解水制氢与氮、氢反应制氨合并(即将电解产生的活性氢作为中间产物直接还原氮气),其工作原理示意图如下:写出阴极电极方程式________。

(3)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+ O2(g) 4N2(g)+6H2O(g),
4N2(g)+6H2O(g),
①已知4NH3(g)+ 3O2(g) 2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;
2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;
N2(g)+ O2(g) 2NO(g) ΔH2 = +180.8 kJ/mol
2NO(g) ΔH2 = +180.8 kJ/mol
则反应4NH3(g)+4NO(g)+ O2(g) 4N2(g)+6H2O(g)的ΔH = ________。
4N2(g)+6H2O(g)的ΔH = ________。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应容器中反应10时测得NOx的去除率随反应温度的变化曲线如下图所示,请解释当反应温度高于380℃时NOx的去除率随温度升高先迅速下降后缓慢下降的原因________。
③请在下图中画出反应8min时NOx的去除率随温度变化的曲线。___

3Fe(s)+4CO2(g),阻碍循环反应的进行。

3FeO(s)+CO2(g);△H1=+19.3 kJ·mol-1
Fe3O4(s)+H2(g);△H2=-57.2 kJ·mol-1
2CO(g);△H3=+172.4 k]·mol-1
2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是___________(填写字母)。




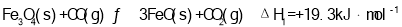 ,反应达到平衡后,在
,反应达到平衡后,在

















