-
下列实验操作规范且能达到相应实验目的的是
选项
实验目的
实验操作
A
配制100g4%的NOH溶液
称取4.0gNaOH放在烧杯中,再加入96.0mL水,搅拌均匀
B.
分离KClO3与MnO2制取O2后的残渣
溶解、过滤、洗涤、干燥滤渣得到MnO2,滤液蒸发结晶并干燥得到KClO3
C
证明 Ksp(BaSO4)< Ksp(BaCO3)
向BaCO3溶液中加入饱和Na2SO4溶液
D
检验Al和Fe2O3反应后固体中是否含Fe2O3
取样,溶于足量稀硫酸,滴加KSCN溶液不变红,说明不含Fe2O3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
将氯气通入品红溶液
溶液红色褪去
氯气具有漂白性
B
将铜粉加入1.0mol•L﹣1
的Fe2(SO4)3溶液中
溶液变蓝,有黑色固体出现
金属Fe比Cu活泼
C
用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点比较低
D
向盛有少量浓硝酸、稀硝酸的两支试管中分别加入一片大小相同的铜片
浓硝酸中铜片很快开始溶解,并放出红棕色气体;稀硝酸中过一会铜片表面才出现无色气体,气体遇空气变红棕色
浓硝酸氧化性强于稀硝酸
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
四种短周期主族元素A、B、M、N 的原子序数依次增大,其原子的最外层电子数之和为19,B 和A元素原子核的质子数之比为2:1,B和M的电子数之差为4。下列说法正确的是
A. 原子半径大小: N>M>B>A
B. A、M、N 三种元素形成的气态氢化物中最稳定的是N的气态氢化物
C. 由A 元素形成的单质的熔沸点都很高,硬度都很大
D. M、N 所形成的氧化物的水化物都是强酸
难度: 中等查看答案及解析
-
化学在生活中有着重要的应用。下列叙述不正确的是()
A. 2019年春节部分地方燃放的“烟花”应用了某些金属的焰色反应
B. 棉 麻 桑蚕丝均是天然有机高分子材料
C. 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用稀硫酸反应即可
D. 医院常用体积分数为75%的酒精溶液进行消毒
难度: 中等查看答案及解析
-
常温下,下列各组离子(或在指定条件下)能大量共存的是
A. 中性溶液:Na+、Fe3+、Cl-、NO3-
B. NH4+、Na+、NO3-、SiO32-
C. 由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:Na+、Mg2+、Cl-、HCO3-
D. 使pH 试纸显蓝色的溶液中:K+、Na+、OH-、SO42-
难度: 中等查看答案及解析
-
根据下列实验现象,所得结论正确的是
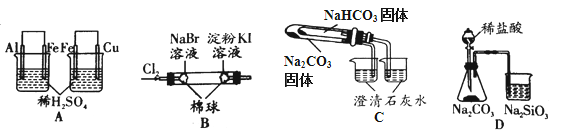
实验
实验现象
结论
A
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡
氧化性:Al3+>Fe2+>Cu2+
B
左边棉花变为橙色,右边棉花变为蓝色
氧化性:Cl2>Br2>I2
C
右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化
热稳定性:Na2CO3>NaHCO3
D
锥形瓶中有气体产生,烧杯中液体变浑浊
非金属性:Cl>C>Si
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
已知:pK=-lgK,25℃时,二元酸H2A的pK1= 1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2- )=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
难度: 困难查看答案及解析



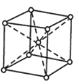

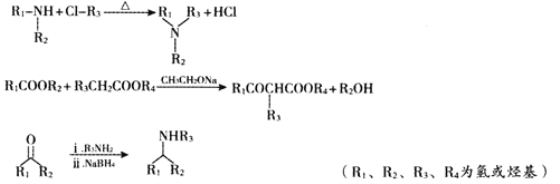
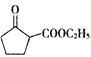 是一种重要的化工中间体。以环已醇(
是一种重要的化工中间体。以环已醇(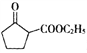 的合成路线____________________。(已知:RCH=CHR’
的合成路线____________________。(已知:RCH=CHR’