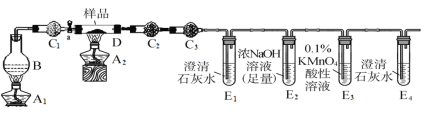
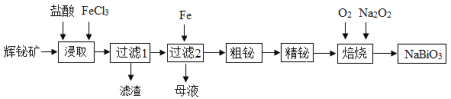
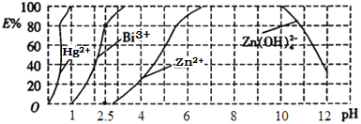
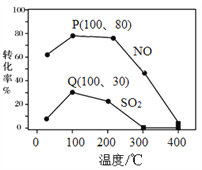
-
化学与生产、生活、科技、环境等密切相关。下列说法正确的是
A. 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3
B. 《抱朴子》中“以曾青涂铁,铁赤色如铜,“曾青”是可溶性铁盐
C. 高铁“复兴号”车厢连接关键部位使用的增强聚四氟乙烯板属于无机高分子材料
D. “华为麒麟980”手机中芯片的主要成分是二氧化硅
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. CO2通过Na2O2使其增重2.8 g,反应中转移电子数为0.2NA
B. 相同质量的Na2O2和Na2S固体具有相同的阴、阳离子数和质子数
C. 用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7 g时,可制得标准状况下氯气2.24 L(不考虑氯气的溶解;电池工作时MnO2转化为MnOOH)
D. 常温下CH3COONH4的pH=7,则0.5 mol·L-1的CH3COONH4溶液中,NH4+浓度为0.5 mol·L-1
难度: 困难查看答案及解析
-
下列实验操作和现象对应所得到的结论正确的是()
选项
实验操作和现象
结论
A
向有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅
Na2CO3溶液中存在水解平衡
B
向2 mL1 mol/L NaOH溶液中加入几滴1 mol/L MgCl2溶液,生成白色沉淀,再加人几滴1 mol/L FeCl3溶液,生成红褐色沉淀
证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀
C
取淀粉溶液于试管中,加入稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2悬浊液,加热,无砖红色沉淀产生
淀粉没有发生水解反应
D
将某Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液显红色
Fe(NO3)2样品已氧化变质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
关于有机物a(
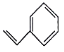 )、b(
)、b(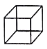 )、c(
)、c(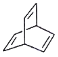 )的说法错误的是
)的说法错误的是A. a、b、c互为同分异构体
B. a、c均能使酸性高锰酸钾溶液褪色
C. a、c与足量氢气反应消耗氢气的物质的量之比是4∶3
D. a、b、c的一氯代物分别有4种、1种、2种(不考虑立体异构)
难度: 中等查看答案及解析
-
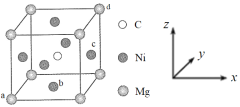
短同期主族元素W、X、Y、Z的原子序数依次增大,W原子核外最外层电子数是次外层的2倍,也是Y原子最外层电子数的2倍,X与Z同主族。Y单质能在X单质中燃烧,生成的二元化合物与H2O反应,产生的气体能使湿润的红色石蕊试纸变蓝。下列说法正确的是
A. 简单离子半径:r(Z)>r(Y)>r(X)
B. 气态氢化物的沸点:Z>X>W
C. 含氧酸的酸性:X>Z>W
D. Y单质能与W的氧化物发生置换反应
难度: 中等查看答案及解析
-
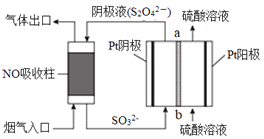
图1为“镁﹣次氯酸盐”燃料电池原理示意图。图2为“双极室成对电解法”生产乙醛酸原理示意图,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是
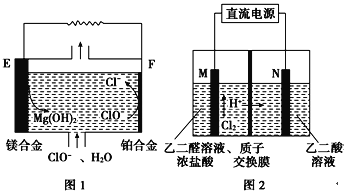
A. 若利用镁燃料电池为电源,则E极连M极
B. 镁燃料电池负极容易与水发生自腐蚀产生氢气
C. F电极上的电极反应式为ClO-+2e-+H2O=Cl-+2OH-
D. 图2装置中若有2 mol H+通过质子交换膜完全反应,则共生成2 mol乙醛酸
难度: 中等查看答案及解析
-
常温下,向20 mL 0.2 mol·L-1二元酸H2A溶液中滴加0.2 mol·L-l NaOH溶液,有关微粒物质的量变化如图。下列叙述正确的是( )
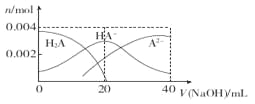
A. 当V(NaOH)="20" mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c( A2-)>c( OH-)> ((H+)
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大
C. 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大
D. 当V(NaOH) ="40" mL时,升高温度,c(Na+)/c(A2-)减小
难度: 中等查看答案及解析