-
化学与生活、生产密切相关,下列说法不正确的是
A. 用灼烧的方法可以区分蚕丝和人造纤维
B. 按照规定对生活废弃物进行分类放置有利于保护环境
C. 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
D. 光导纤维是无机非金属材料,合成纤维是有机高分子材料
难度: 简单查看答案及解析
-
下列实验方案中,可以达到实验目的的是
选项
实验目的
实验方案
A
除去苯中混有的苯酚
加入适量的溴水充分反应后过滤
B
制取Fe(OH)3胶体
向沸水中滴加FeCl3饱和溶液,继续加热至红褐色,停止加热
C
验证酸性:
CH3COOH>HClO
使用pH试纸分别测定相同温度下相同浓度的CH3COONa溶液和NaClO溶液的pH
D
检验溶液中含有I-
向某溶液中加入CCl4,振荡后静置,液体分层,下层呈紫红色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
W、X、Y、Z是四种短周期非金属元素,原子序数依次增大。W是原子半径最小的元素,X、Y原子核外L层的电子数之比为3∶4,X与Z同主族,W、X、Y、Z的最外层电子数之和为17。下列说法正确的是
A. 单质的沸点:X>Z
B. X与W形成的化合物中一定只有极性键
C. 氢化物的热稳定性:Z>Y
D. W、X、Y可形成离子化合物
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 1 mol H2和1 mol I2在加热条件下充分反应,生成HI的分子数为2NA
B. 10g质量分数为46%的乙醇溶液含有的氢原子数目为0.6NA
C. 20 mL 0.1 mol/L AlCl3溶液中,水解形成Al(OH)3胶体粒子数为0.002NA
D. 0.1molNa2O2和Na2O的混合物中含有的离子总数等于0.3NA
难度: 中等查看答案及解析
-
下列有关有机化合物(a)
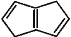 (b)
(b)(c)
的说法正确的是
A. (a)(b)(c)均能与溴水发生化学反应
B. (b)二氯代物有两种
C. (a)(b)(c)互为同分异构体
D. (a)中所有原子可能共平面
难度: 中等查看答案及解析
-
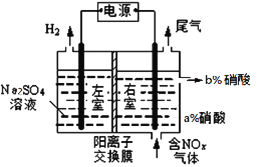
电解絮凝净水可用如图装置模拟探究,下列叙述正确的是
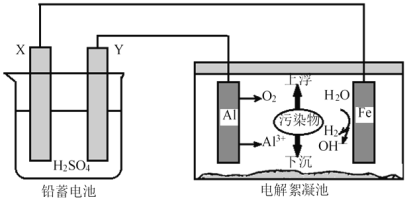
A. 电子从X极经电解液流入Y极
B. 铝电极表面的反应有:Al -3e-=Al3+,4OH--4e-=O2↑+2H2O
C. Y的电极反应:Pb-2e-+SO42- = PbSO4
D. 电路每通过2mol电子,理论上电解池阴极上有22.4 L H2生成
难度: 中等查看答案及解析
-
室温下,向H2C2O4溶液中滴加NaOH溶液,若pc=-lg c,则所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)与溶液pH的关系如图所示。下列说法正确的是
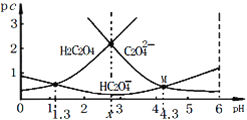
A. M点时, 2c(HC2O4-)+c(C2O42-) >c(Na+)
B. pH=x时,c(HC2O4-)<c(H2C2O4)=c(C2O42-)
C. 常温下,Ka2(H2C2O4)=10-1.3
D.
随pH的升高而减小
难度: 困难查看答案及解析
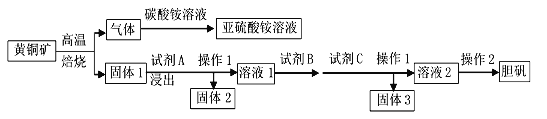
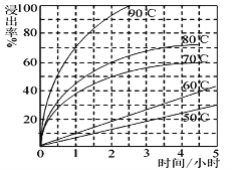
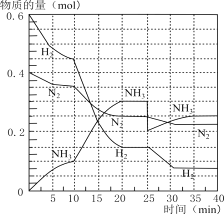
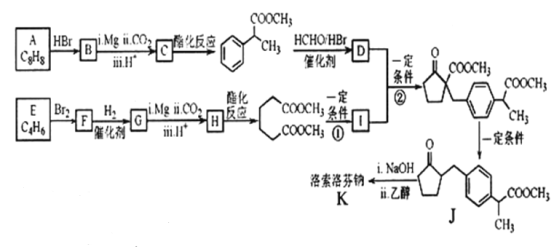
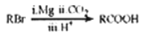
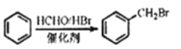
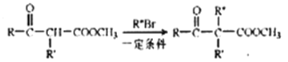
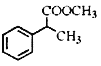 互为同分异构体,且符合下列要求的结构共有_______种。
互为同分异构体,且符合下列要求的结构共有_______种。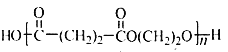 ),写出最多不超过5步的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_____________________
),写出最多不超过5步的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_____________________