-
大气与生态圈的氮循环如图所示,下列叙述不正确的是
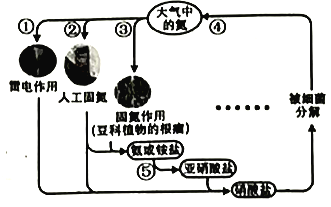
A. ④维持大气中氮元素含量稳定
B. ①是野生植物生长所需氮元素的重要来源
C. ⑤为硝化过程、④为反硝化过程,都是氮元素的还原反应过程
D. ②是氮肥工业基础,科学家努力将固氮变化条件趋近生物固氮
难度: 中等查看答案及解析
-
苯乙烯(
)是有机合成的重要原料。下列对它结构与性质的推测错误的是
A. 可作为加聚反应的单体 B. 苯环上的一氯代物有5种
C. 空气中燃烧将产生大量黑烟 D. 分子中所有原子可能处于同一平面
难度: 中等查看答案及解析
-
下列实验方案中,可以达到实验目的的是
选项
实验目的
实验方案
A
制取Fe(OH)3胶体
向沸水中滴加FeCl3饱和溶液,继续加热得透明红色液体
B
证明乙醇分子中含有一个羟基
向3g金属钠和含有1mol溶质的乙醇溶液作用恰好产生0.5molH2
C
验证酸性:CH3COOH>HClO
使用pH试纸分别测定相同温度下相同浓度的CH3COONa溶液和NaClO溶液的pH
D
检验淀粉是否发生水解
向淀粉溶液中加入稀H2SO4,加热一段时间,冷却后滴加碘水,观察是否出现蓝色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 1 mol Na2O2晶体中共含有4NA个离子
B. 标准状况下,22.4LCH3OH含有NA个分子
C. 常温下,1LpH=1的H2SO4溶液中,含有0.2NA个H+
D. 标准状况下,22.4LN2和O2的混合气体中含有的原子数为2NA
难度: 中等查看答案及解析
-
原子序数依次递增的Q、W、X、Y、Z五种元素中,Q、W、X是分别位于前三个周期且原子最外层电子数之和为10的主族元素,W与Y同主族、X和Y同周期;X是地壳中含量最高的金属元素、Z存在胆矾之中。下列关于它们的叙述合理的是
A. 最高价氧化物对应水化物的酸性比X比Z强
B. W与X简单离子半径后者更大
C. W、Y两种元素最高化合价相同
D. X、Z两种金属在两千多年前就被我们祖先广泛使用
难度: 中等查看答案及解析
-
乙醛酸(HOOC-CHO)是一种重要的有机合成中间体。在乙二酸( HOOC-COOH)电还原法合成乙醛酸的基础上化学工作者创新性地提出双极室成对电解法装置模型及工作原理如图所示。下列说法中错误的是
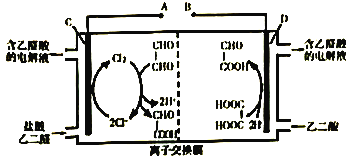
A. 该离子交换膜应选择阳离子交换膜
B. HCl是制取乙醛酸反应的催化剂,并起导电作用
C. 该方法的总反应为 OHC-CHO+HOOC-COOH
2HOOC-CHO
D. 乙二醛、乙二酸分别在阴、阳电极表面放电,故称为双极室成对电解法
难度: 中等查看答案及解析
-
室温下向20mL含0.10mol·L-1Cr2+和0.10mol·L-1Fe2+的混合溶液中滴加0.10 mol·L -1NaOH溶液,金属阳离子浓度与滴入NaOH溶液体积的关系曲线如图所示。若溶液中金属离子浓度小于10-5mol·L-1视为完全沉淀,则下列说法错误的是
[Cr(OH)2的ksp为2×10-16,Fe(OH)2的ksp为8×10-16]
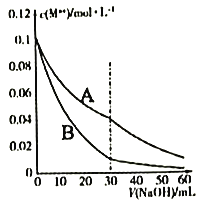
A. 曲线A表示c(Fe2+)
B. 当V(NaOH)=30mL时,Fe2+开始沉淀
C. 当pH=7时溶液中Fe2+、Cr2+均完全沉淀
D. V(NaOH)>30mL时,溶液中c(Fe2+)︰c(Cr2+) =4.0
难度: 中等查看答案及解析