-
我国成功实现持续开采可燃冰。可燃冰是天然气和水在海底300m-3000m的深度形成的固体,可表示为mCH4·nH2O。下列哪个条件不是形成可燃冰必须具备的
A. 低压 B. 低温 C. 高压 D. 充足的CH4来源
难度: 简单查看答案及解析
-
2018年10月22日,中国科学家王中林院士获世界能源领域最高奖—被誉为“能源界诺贝尔奖”的埃尼奖(EniAward),以表彰他在纳米发电机和 海洋“蓝色能源”技术领域对世界能源发展做出的重大贡献。下列与海洋能一样属于可再生能源的是
A. 氢气 B. 煤 C. 石油 D. 天然气
难度: 简单查看答案及解析
-
我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是
A. 反应进行的方向 B. 反应的快慢 C. 反应进行的限度 D. 反应物的颜色
难度: 简单查看答案及解析
-
下列各组物质中,前者是强电解质,后者是弱电解质的是
A. NaCl、BaSO4 B. HCl、NaHSO4 C. KNO3、CH3COOH D. NH3·H2O、H2SO4
难度: 简单查看答案及解析
-
控制变量法是化学实验的常用方法之一。下图实验探究影响反应速率的因素是

A. 浓度 B. 温度 C. 催化剂 D. 固体质量
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液中,c(NH4+)最大的是
A. NH4Cl B. CH3COONH4 C. NH4HCO3 D. NH4HSO4
难度: 简单查看答案及解析
-
pH值相等的盐酸(甲)和醋酸(乙),盐酸与醋酸浓度的大小关系是
A. 甲=乙 B. 甲>乙 C. 甲<乙 D. 不确定
难度: 简单查看答案及解析
-
下列实验事实或数据能说明次氯酸为弱电解质的是
A. 次氯酸具有漂白性 B. 常温时,次氯酸水溶液的pH < 7
C. 次氯酸不稳定,易分解 D. 0.001 mol•L-1 HClO溶液的pH = 5
难度: 简单查看答案及解析
-
常温下将pH=8的NaOH溶液稀释1000倍,稀释后溶液中c(Na+)与c(OH-)之比接近
A. 1:1 B. 1:102 C. 102:1 D. 1:103
难度: 简单查看答案及解析
-
下列实验现象不能充分说明相应的化学反应是放热反应的是
选项
A
B
C
D
反应装置或图像
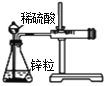
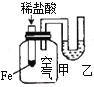
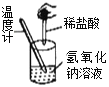
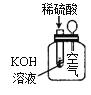
实验现象或图像信息
反应开始后,针筒活塞向右移动
反应开始后,甲侧液面低于乙侧液面
温度计的水银柱上升
反应开始后,气球慢慢胀大
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B. 由水电离的c(H+)=1×10-14 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C. c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D. c(Fe3+)=0.1 mol•L-1的溶液中:K+、CO32-、NO3-、SCN-
难度: 中等查看答案及解析
-
下列有关化学符号表征正确的是
A. 电解法精炼铜,阴极电极反应:Cu2++2e-== Cu
B. H2S在水溶液中的电离:H2S
2H++ S2-
C. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4 (g)+2O2 (g) ==CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D. 碳酸钠水解的离子方程式:CO32-+2H2O
2OH-+H2CO3
难度: 简单查看答案及解析
-
某反应由两步反应A
B
C构成,它的反应能量曲线如图,下列叙述正确的是

A. 两步反应均为吸热反应 B. 三种化合物中C最稳定
C. A与C的能量差为E4 D. A
B反应,反应条件一定要加热
难度: 中等查看答案及解析
-
下列事实能用勒夏特列原理解释的是
A. 工业制硫酸在二氧化硫催化氧化时采用高温来提高单位时间SO3的产量
B. 合成氨工业中使用铁触媒做催化剂来加快反应速率
C. 用饱和食盐水来除去氯气中氯化氢杂质
D. 对于2HI(g)
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
难度: 中等查看答案及解析
-
2018年10月24日港珠澳大桥正式通车。深埋在海水中的钢管桩易发生腐蚀,但中科院金属研究所研发的技术能保障大桥120年耐久性。下列保护钢管桩的措施不合理的是
A. 使用抗腐蚀性强的合金钢 B. 钢管桩附着铜以增强抗腐蚀性
C. 使用防止钢筋锈蚀的海工混凝土 D. 在钢筋表面覆盖一层高性能防腐涂料
难度: 简单查看答案及解析
-
下列实验操作规范且能达到实验目的的是
选项
实验目的
操作
A
取20.00 mL盐酸
在25 mL酸式滴定管中装入盐酸。调整初始读数为5.00 mL后,将剩余盐酸全部放入锥形瓶中
B
测量饱和Na2CO3溶液的pH值
用蒸馏水湿润pH试纸,放入Na2CO3溶液中,观察pH试纸颜色,并与比色卡对比,读出pH值
C
制取纯净的FeCl 3固体
加热蒸干FeCl3溶液
D
验证Ksp[Cu(OH)2]< Ksp[Mg(OH)2]
将0.1 mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol/L CuSO4溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g) ΔH>0,下列图象中正确的是
A.
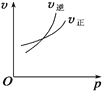 B.
B.  C.
C.  D.
D. 
难度: 中等查看答案及解析
-
电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质M。下列有关分析或说法中正确的是
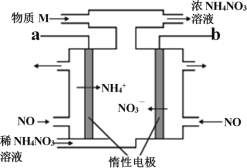
A. a 应接直流电源的正极
B. 补充的物质M是NH3
C. 阳极的电极反应式: NO+5e-+6H+=NH4++H2O
D. 电路中通过5mol 电子时,理论上最多可处理22.4L NO气体(标准状况)
难度: 中等查看答案及解析
-
把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)
Ca2+(aq)+
2OH-(aq),下列叙述正确的是( )
A. 给溶液加热,溶液的pH升高
B. 恒温下向溶液中加入CaO,溶液的pH升高
C. 向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多
D. 向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多
难度: 中等查看答案及解析
-
中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如下图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法正确的是
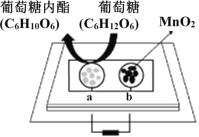
A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. 消耗0.01mol葡萄糖,电路中转移0.02mol电子
D. b极的电极反应式为:MnO2+2H2O+2e-=Mn2++4OH-
难度: 中等查看答案及解析
-
常温下,现有0.1mol•L﹣1 NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示:
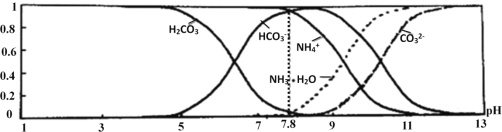
下列说法不正确的是( )
A. 分析可知,常温下Kb(NH3•H2O)>Ka1(H2CO3)
B. 0.1 mol•L-1 NH4HCO3溶液中存在:c(NH3•H2O)=c(H2CO3)+c(CO32-)
C. 当溶液的pH=9时,溶液中存在:c(HCO3-)> c(NH4+)>c(NH3•H2O)>c(CO32-)
D. 向pH=7.8的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3﹣浓度逐渐减小
难度: 中等查看答案及解析