-
2015年10月,浙江籍科学家屠呦呦因发现青蒿素(C15H22O5)而获得诺贝尔生理学或医学奖。根据物质的分类,青蒿素属于
A. 碱性氧化物 B. 有机物
C. 含氧酸盐 D. 酸性氧化物
难度: 简单查看答案及解析
-
35Cl和 35Cl- 两种微粒中,不同的是
A. 核内质子数 B. 核外电子层数 C. 核内中子数 D. 核外电子数
难度: 简单查看答案及解析
-
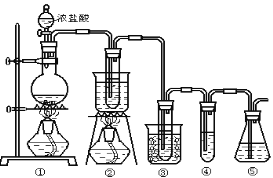
下列玻璃仪器中,可以用酒精灯直接加热的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
在下列反应中,HCl作还原剂的是( )
A. NaOH + HCl = NaCl + H2O
B. Zn + 2HCl = ZnCl2 + H2↑
C. MnO2 + 4HCl(浓)
MnCl2 + 2H2O + Cl2↑
D. CuO + 2HCl = CuCl2 + H2O
难度: 中等查看答案及解析
-
根据化学常识判断下列说法正确的是( )
A. 铅笔芯是主要含有铅的笔芯 B. 加碘食盐是加有I2的食盐
C. 碘酒是含有的I2的酒精 D. 纯碱是纯净的烧碱
难度: 简单查看答案及解析
-
氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是( )
A. 金属冶炼 B. 燃放鞭炮 C. 食物腐败 D. 豆浆变成豆腐
难度: 简单查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是( )
A. 在标况下11.2L CH4和22.4L O2充分反应后恢复到原条件,所得气体分子数为1.5NA
B. 标况下3.36LCCl4中所含碳原子数约为0.15×6.02×1023
C. 78gNa2O2晶体中所含阴阳离子个数约为3×6.02×1023
D. 2L 1mol/L的盐酸中所含氯化氢分子数约为2×6.02×1023
难度: 简单查看答案及解析
-
二氧化硅是一种酸性氧化物,下列物质中不能和二氧化硅发生化学反应的是( )
A. 氢氟酸 B. 碳(高温下) C. 碳酸钠(高温下) D. 水
难度: 简单查看答案及解析
-
下列物质放在敞口容器中久置,其质量会减少的是( )
A. 浓硫酸 B. 固体苛性钠 C. 过氧化钠 D. 十水碳酸钠晶体
难度: 简单查看答案及解析
-
随着人们对物质组成和性质研究的深入,物质的分类更加多样化。下列有关说法正确的是( )
A. Na2O2、Al2O3、Fe2O3都是碱性氧化物 B. 磁铁矿、盐酸、绿矾都是混合物
C. CH3COOH、NH3·H2O、HClO都是弱电解质 D. 烧碱、纯碱、熟石灰都是碱
难度: 简单查看答案及解析
-
在某无色的强酸性溶液中,能大量共存的离子组是( )
A. NH4+、Cu2+、Cl-、Br- B. Na+、K+、CO32-、Cl-
C. K+、Fe3+、I-、SO42- D. K+、Mg2+、SO42-、Cl-
难度: 简单查看答案及解析
-
下列有关实验操作正确的是( )
A.
 B.
B. 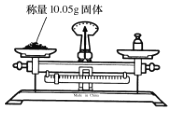 C.
C. 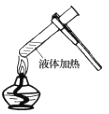 D.
D. 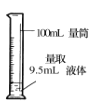
难度: 简单查看答案及解析
-
下列说法正确的是
A. 受溴腐蚀至伤时,先用稀 NaOH 溶液洗,再用水洗
B. 用蒸馏的方法可以分离水和汽油 (沸点 20~200℃)
C. 绿色化学的核心是对环境污染物进行无害化处理
D. SO2 能与CaO反应,可用生灰石作工业废气的脱硫剂
难度: 中等查看答案及解析
-
玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,一般需要使用玻璃棒进行操作的是( )
①用NaCl固体配制一定物质的量浓度的溶液
②从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
③实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
④从含NaCl的溶液中获得蒸馏水 ⑤用CCl4萃取碘水中的碘
A. ②③ B. ③④⑤ C. ⑤ D. ①②
难度: 简单查看答案及解析
-
在学习了溶液中的离子反应之后,小明同学认为反应中的先后顺序很重要。因此他归纳了下面一些情况,在他所作的整理中,你认为正确的是 ( )
A. 向浓度都为0.1 mol/L 的FeCl3和CuCl2混合溶液加入铁粉,CuCl2首先反应
B. 向NH4HSO4溶液中滴加少量的NaOH溶液,NH4+首先反应
C. 向浓度都为0.1 mol/LNa2 CO3和NaOH溶液通入CO2气体,NaOH首先反应
D. 向FeCl3溶液中加入质量相同、颗粒大小相同的铁和铜,铜先反应
难度: 简单查看答案及解析
-
下列实验方法合理且离子方程式正确的是( )
A. 用稀硫酸除去 Cu 中的 Fe2O3 杂质:Fe2O3 +6H+=2Fe3+ +3H2O
B. 实验室利用稀盐酸和石灰石制 CO2: CaCO3+2H+=Ca2++H2O+CO2↑
C. 用盐酸制硅胶:Na2SiO3+ 2H+=2Na++H2SiO3↓
D. 检验溶液中的 Fe3+:Fe3+ +3SCN- =Fe(SCN)3↓(红色)
难度: 简单查看答案及解析
-
下列表述正确的是( )
①开发使用新型清洁能源,减少化石燃料的燃烧,可从根本上防止酸雨的产生
②我国用二氧化氯取代氯气对饮用水进行消毒,是因为二氧化氯杀菌、消毒能力强,持效长
③氧化镁可用来制造耐火砖和坩埚等
④明矾能使水中的悬浮物凝聚,可做为净水剂
⑤建设三峡大坝使用了大量水泥,水泥是硅酸盐材料
A. ①④⑤ B. ①②⑤ C. ②③④ D. 全部
难度: 简单查看答案及解析
-
下列试剂中混有的杂质,其除杂试剂和分离操作都正确的是
编号
主要成分
杂质
除杂试剂
分离操作
A
铜粉
铁粉
FeCl3溶液
过滤
B
Na2SO4
Na2SO3
双氧水
结晶
C
SO2
HCl
饱和Na2CO3
洗气
D
MgO
Al2O3
盐酸
过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将赤铜矿(Cu2O)与辉铜矿(Cu2S)混合加热发生以下反应:2Cu2O+Cu2S
6Cu+SO2↑,下列说法错误的是
A. 在Cu2O、Cu2S中Cu元素化合价都是+1价 B. 反应中Cu元素被氧化,S元素被还原
C. Cu2S在反应中既是氧化剂,又是还原剂 D. 每生成6.4gCu,反应中转移0.1mol e-
难度: 简单查看答案及解析
-
将Cl2通入适量 KOH溶液,产物中可能有KCl、KClO、KClO3,且c(Cl-)/c(ClO-)的值与温度高低有关。当 n(KOH)=a mol 时,下列有关说法错误的是( )
A. 若某温度下,反应后c(Cl-)/c(ClO-)=11,则溶液中c(ClO-)/c(ClO3-)=1:2
B. 参加反应的氯气的物质的量等于a/2 mol
C. 改变温度,产物中 KClO3的最大理论产量为a/7mol
D. 改变温度,反应中转移电子的物质的量ne-的范围:a/2mol≤ne-≤5a/6mol
难度: 中等查看答案及解析
-
装有 Fe2O3、 CuO、 Fe、 Cu 的烧杯中加入过量稀硫酸,充分反应后,仍有红色粉末剩余,则关于反应后溶液中金属阳离子的判断一定正确的是
A. 一定有Fe2+,可能有Cu2+ B. 只有Fe2+
C. 一定有Fe2+、Cu2+,可能有Fe3+ D. 只有Fe2+和Fe3+
难度: 中等查看答案及解析
-
某溶液中含有 HCO3-、SO32-、CO32-、CH3COO-等 4 种阴离子。若向其中加入足量的Na2O2 后,溶液中离子浓度变化最小的是( )
A. CO32- B. SO32- C. CH3COO- D. HCO3-
难度: 简单查看答案及解析
-
食用加碘盐常是将KIO3或KI按一定比例加入食盐中配置而成。已知:氧化性:IO3->I2。 下列说法不正确的是( )
A. 以 KIO3 作为加碘剂时,碘不易损失,说明 KIO3 稳定,在高温时不会分解
B. 以 KIO3 作为加碘剂时,将该加碘盐溶于稀硫酸,将该溶液滴在淀粉碘化钾试纸上,试纸会变蓝色
C. 以 KI 作为加碘剂时,可加入某些物质作为稳定剂以减少碘的损失
D. 某地的食盐中含少量的Fe2+,宜选用KI作为加碘剂
难度: 中等查看答案及解析
-
有FeO、 Fe2O3的混合物若干克,在CO气流中加热充分反应,冷却后称剩余固体比原混合物质量减轻1.6 g,若将同质量的混合物与盐酸反应,欲使其完全溶解需1 mol/L 的盐酸的体积为( )
A. 200mL B. 100mL C. 50mL D. 无法计算
难度: 中等查看答案及解析
-
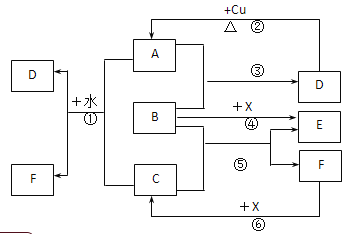
某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如下图所示的实验,每次实验所加试剂均过量。已知稀HNO3具有强氧化性。下列说法不正确的是( )
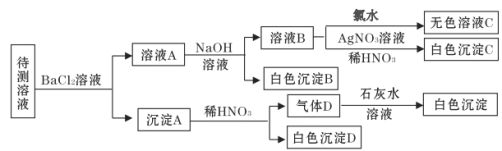
A. SO42-、SO32-至少含有一种 B. 沉淀B的化学式为 BaCO3
C. 肯定存在的阴离子有 CO32-、HCO3-、Cl- D. Br—肯定不存在
难度: 中等查看答案及解析