-
化学与生活息息相关,下列有关说法不正确的是
A. 我国发射“嫦娥三号”卫星所使用的碳纤维是一种非金属材料
B. 食用油的主要成份是油脂,其成分与汽油、煤油不相同
C. 《本草拾遗》记载“醋……消食,杀恶毒……,其中醋的有效成分是乙酸
D. PM2.5是指大气中直径接近2.5×10-6m的颗粒物,颗粒物分散在空气中形成胶体
难度: 中等查看答案及解析
-
环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(
)是最简单的一种。下列关于该化合物的说法正确的是
A. 与环戊烯不是同分异构体 B. 二氯代物超过两种
C. 生成1molC5H12,至少需要3molH2 D. 与丙炔互为同系物
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 0.2 mol FeI2与足量氯气反应时转移电子数为0.4NA
B. 常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA
C. 标准状况下,2.24LCCl4含有的共价键数为0.4NA
D. 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子
难度: 中等查看答案及解析
-
Ⅹ、Y、Z、W、M五种元素的原子序数依次增大。已知Ⅹ、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是
A. 原子半径:r(M)>r(Y)>r(Z)>r(W)>r(X)
B. W和M形成的化合物不能与强碱反应
C. Ⅹ、Z、W三元素所形成的化合物一定为共价化合物
D. Y、Z的最高价含氧酸的酸性:Y>Z
难度: 中等查看答案及解析
-
根据实验操作和现象所得出的结论正确的是
选项
实验操作
现象
结论
A
向FeCl3饱和溶液中滴入足量浓氨水,并加热至沸
生成红褐色透明液体
得到Fe(OH)3胶体
B
向KI溶液中加入淀粉,然后加入稀硫酸搅拌
开始无明显现象,片刻溶液变蓝
氧化性H2SO4 >I2
C
将浸透石蜡油的石棉网放置在硬质试管底部,加入少量碎瓷片并加热,将生成的气体通入酸性高锰酸钾溶液中。
高锰酸钾溶液褪色
石蜡油分解产物中生成不饱和烃
D
向待测液中加入适量的稀NaOH溶液,将湿润的蓝色石蕊试纸放在试管口
湿润的蓝色石蕊试纸未变红
待测液中不含有NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某新型水系钠离子电池工作原理如图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4还原为Na2S,下列说法不正确的是
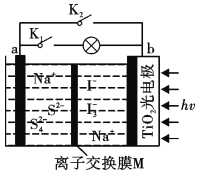
A. 充电时,太阳能转化为电能,电能又转化为化学能
B. 放电时,a极为负极
C. 充电时,阳极的电极反应式为3I――2e-=13-
D. M是阴离子交换膜
难度: 中等查看答案及解析
-
常温下,向10.0mL0.10mol·L-1某二元酸H2R溶液中滴入同物质的量浓度的NaOH溶液,测得溶液的pH随NaOH溶液体积的变化如图所示。下列说法中正确的是

A. HR-的电离能力大于水解能力
B. 曲线上m点时溶液中c(Na+)>c(HR-)>c(R2-)>c(H+)
C. 无法判断H2R是强酸还是弱酸
D. 溶液中c(Na+)+c(H+)=c(HR-)+c(R2-)+c(OH-)
难度: 中等查看答案及解析

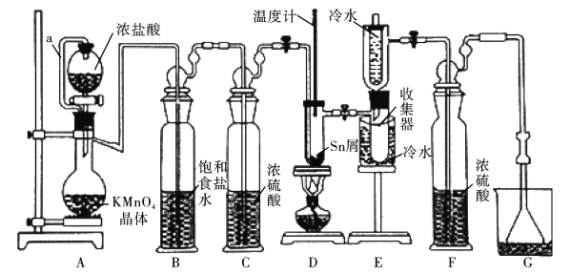

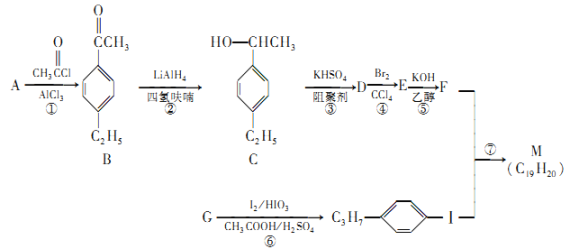
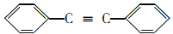 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线如下:(部分反应条件略去)
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线如下:(部分反应条件略去)