-
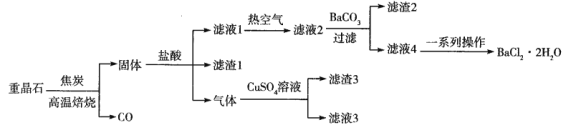
某电镀污泥含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量金等,某小组设计如下资源综合利用的方案:
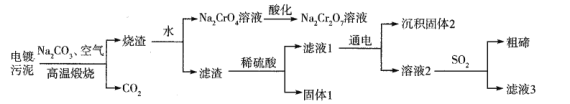
已知:碲和硫位于同主族,煅烧时Cu2Te发生的反应为Cu2Te+2O2
2CuO+TeO2,滤渣中TeO2溶于稀硫酸发生的反应为TeO2+H2SO4=TeOSO4+H2O。下列说法不正确的是
A. “高温”灼烧电镀污泥时铜碲和铬元素都被氧化
B. 酸化Na2CrO4溶液时可用浓盐酸
C. 上述流程可以回收的金属单质有金和铜
D. 滤液3可以循环利用
难度: 中等查看答案及解析
-
有机化学与生活密切联系。下列说法不正确的是
A. 淀粉、有机玻璃和蛋白质都是高分子化合物
B. 四氯化碳和氯仿常作碘水中碘的萃取剂
C. 乙烯和氯乙烯都可用于制造食品外包装材料
D. 工业酒精中甲醇等有害成分含量高,严禁作饮料
难度: 简单查看答案及解析
-
氮化锂(Li3N)常作固体电解质和催化剂,遇水蒸气剧烈反应生成氢氧化锂和氨气。某实验小组用一瓶氮气样品制备纯净的氮化锂的装置如图所示。
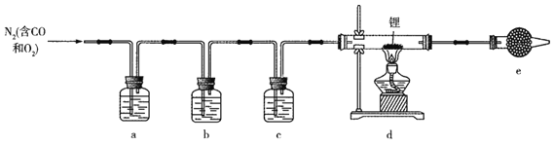
已知:连苯三酚碱性溶液能定量吸收少量O2,氯化亚铜盐酸溶液能定量吸收少量CO生成Cu(CO)Cl·H2O且易被O2氧化;在加热条件下,CO2与锂发生剧烈反应。下列说法正确的是
A. 干燥管e中试剂为无水CuSO4,用于检验氮气中的水蒸气
B. 为了减少气体用量,先点燃酒精灯再通入氮气
C. a、c中试剂分别为连苯三酚碱性溶液、浓硫酸
D. a装置可以换成盛装赤热铜粉的硬质玻璃管
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值。下列说法正确的是
A. 1mol
Yb(镱)中含有的中子数为70NA
B. 常温下,1LpH=13的Ba(OH)2溶液中由水电离的OH-数目为0.1NA
C. 在锌锰碱性电池中消耗13.0g负极材料,转移电子数为0.2NA
D. 常温常压下,28.0g丙烯和乙烯的混合气体中含有的氢原子数为4NA
难度: 中等查看答案及解析
-
某有机物R的结构如右所示。下列说法不正确的是
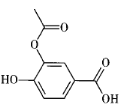
A. R的分子式为C9H8O5
B. R分子中的所有原子可能共平面
C. R能发生酯化、水解、加成反应
D. 与R含有相同取代基的苯环上的位置异构体还有9种
难度: 中等查看答案及解析
-
短周期主族元素R、X、Y、Z的原子序数依次增大,R的最简单气态氢化物分子的空间结构为正四面体,X的+1价阳离子的电子层结构与氖原子相同。元素X和Z形成化合物G,G中X和Z元素的质量之比为23︰16,有两种含Y元素的可溶性化合物E和F,在10mL1.0mol·L-1E溶液中滴加1.0mol·L-1F溶液,产生沉淀的物质的量(n)与F溶液体积(V)的关系如图所示。下列说法一定正确的是
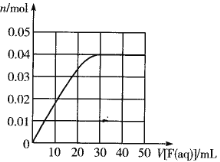
A. 原子半径:X>Y>R
B. 最高价氧化物对应水化物的酸性:Z>Y>R
C. X和Y的单质组成的混合物不能完全溶于水
D. 工业上,通过电解熔融氯化物制备Y的单质
难度: 中等查看答案及解析
-
四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb=3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。
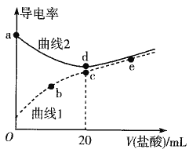
下列说法正确的是
A. 曲线1代表四甲基氢氧化铵溶液
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b点溶液中存在c(H+)=c(OH-)+c(CH3NH2·H2O)
D. 常温下,CH3NH3Cl水解常数的数量级为10-11
难度: 困难查看答案及解析