-
以重晶石(主要成分是BaSO4,含Al、Fe等元素的杂质)为原料制备产品(BaCl2·2H2O)的一种流程如下:
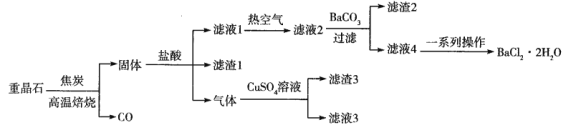
已知:滤液2主要含BaCl2,还含有AlCl3、FeCl3和HCl等杂质。298K下,Fe(OH)3、Al(OH)3完全沉淀的pH依次为3.0和5.4。
回答下列问题:
(1)高温焙烧时将重晶石粉碎的目的是______________________。若4.66 g BaSO4完全反应转移9.632×1022个电子,写出BaSO4与C反应的化学方程式:______________________。
(2)“固体”(微溶于水)与盐酸反应生成的一种气体通入CuSO4溶液中产生黑色沉淀,则生成该气体的离子方程式为______________________。滤渣3的成分是___________(填化学式)。
(3)加入BaCO3的目的是____________________________________________。
(4)常温下,Fe3+沉淀完全[溶液中c(Fe3+)=1×10-5mol·L-1]时溶液的pH=3,则Fe(OH)3的Ksp约为_____。
(5)滤液4经蒸发浓缩、降温结晶、过滤,洗涤和干燥,得到产品。采用电化学法以过滤后的废液为原料制备Ba(OH)2,实现资源综合利用和环境保护。气体X的电子式为____________________;写出阴极的电极反应式:__________________。

-
氯化钡是白色的晶体,易溶于水,微溶于盐酸和硝酸,难溶于乙醇和乙醚,易吸湿,需密封保存。工业上制备BaCl2·2H2O有如下两种途径:
途径1:以重晶石(主要成分BaSO4)为原料,流程如下:
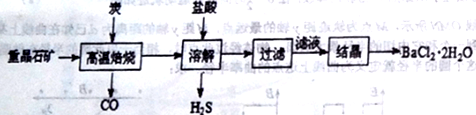
(1)写出“溶解”时反应的化学方程式方程式:________________________。
(2)“高温焙烧”时必须加入过量的炭,同时还要通入空气,其目的是_____________。
(3)结晶得到的晶体,需用乙醇洗涤的理由是_______________________。
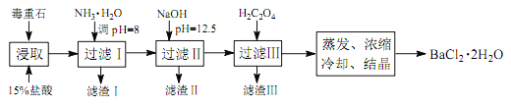
途径2:以毒重石(主要成分BaCO3,含CaCO3、MgCO3、Fe2O3、SiO2等杂质)为原料,流程如下:
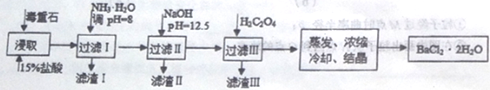
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,Ksp[Mg(OH)2]=1.8×10-11。
| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
(4)滤渣I的成分为________(填化学式)。
(5)滤渣II中含_________(填化学式)。过滤析出后,滤液中含有的Mg2+浓度为_______。
(6)加入H2C2O4时应避免过量,其原因是为了防止生成______(填化学式)。
-
工业上制备 BaCl2·2H2O 有如下两种途径。
途径 1:以重晶石(主要成分 BaSO4)为原料,流程如下:

(1)写出“高温焙烧”时反应的化学方程式: _____________________________________。
(2)“高温焙烧” 时必须加入过量的炭,同时还要通入空气,其目的是____________。
途径 2:以毒重石(主要成分 BaCO3,含 Ca2+、 Mg2+、 Fe3+等杂质)为原料,流程如下:

已知: Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
(3)为提高矿石的浸取率,可采取的措施是_________。
(4)加入 NH3·H2O 调节 pH=8 可除去____ (填离子符号),滤渣Ⅱ中含_________(填化学式)。加入 H2C2O4时应避免过量,原因是_________。
(5)重量法测定产品纯度的步骤为:
准确称取 m g BaCl2·2H2O 试样,加入 100 mL 水, 用 3 mL 2 mol·L-1 的 HCl 溶液加热溶解。边搅拌,边逐滴加入 0.1 mol·L-1 H2SO4 溶液。待 BaSO4 完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含 Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为 n g。则BaCl2·2H2O的质量分数为_________。
-
工业上制备 BaCl2·2H2O有如下两种途径。
途径 1:以重晶石(主要成分BaSO4)为原料,流程如下:
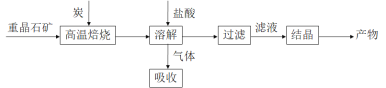
(1)写出“高温焙烧”时反应的化学方程式:_____________________________________。
(2)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为_____________。
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
途径 2:以毒重石(主要成分BaCO3,含Ca2+、Mg2+、Fe3+等杂质)为原料,流程如下:
已知:Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
(4)为提高矿石的浸取率,可采取的措施是_________。
(5)加入 NH3·H2O 调节 pH=8 可除去___________(填离子符号),滤渣Ⅱ中含_________(填化学式)。加入 H2C2O4时应避免过量,原因是_________。
(6)重量法测定产品纯度的步骤为:准确称取 m g BaCl2·2H2O试样,加入100 mL水, 用3 mL 2 mol·L-1 的 HCl溶液加热溶解。边搅拌,边逐滴加入0.1 mol·L-1 H2SO4 溶液。待BaSO4完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为n g。则BaCl2·2H2O的质量分数为_________。
(7)20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g·L-1)如图所示。下列叙述正确的是_______________
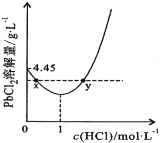
A.盐酸浓度越大,Ksp(PbCl2)越大
B.PbCl2能与一定浓度的盐酸反应
C.x、y两点对应的溶液中c(Pb2+)相等
D.往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)
-
二水氯化钡晶体(BaCl2∙2H2O)在工业上主要用于制造各种钡盐、颜料和有机染料,某研究小组以重晶石(主要成分 BaSO4)制备BaCl2∙2H2O 流程如下图。
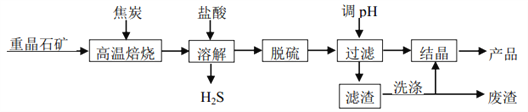
(1)已知:
① BaSO4(s)+ 4C(s)= 4CO(g) + BaS(s) △H1 = 571.2kJ•mol﹣1
② C(s)+ CO2(g)= 2CO(g) △H2 = 172.5 kJ•mol﹣1
反应 BaSO4(s)+ 2C(s)= 2CO2(g)+ BaS(s)的△H = _____ kJ•mol﹣1
(2)高温焙烧须加入过量的炭,同时还要通入空气,其目的是_____、_____。
(3)脱硫过程中分为两步, 第一步是物理脱硫, 第二步是化学脱硫。
① 物理脱硫是直接用蒸汽升温,并用空气“爆气法”除去的物质是_____。
② 下列物质不宜用作脱硫剂的是_____ (填字母)。
A. 高锰酸钾 B. 次氯酸钠 C. 双氧水 D.氯气
(4)上述流程中洗涤滤渣的主要目的是_____。
(5)溶解时产生的 H2S 可用 80~85 ℃时的石灰氮料浆(CaCN2的浆水混合物)吸收并制得更有价值的产品——硫脲[CS(NH2)2]和熟石灰。请写出制备硫脲的化学方程式_____。
-
硫酸盐在生产生活中有广泛应用。
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如下:
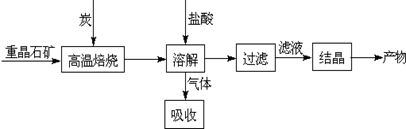
某研究小组查阅资料得:
BaSO4(s)+4C(s) 4CO(g)+BaS(s)△H1=+571.2kJ•mol-1 ①
4CO(g)+BaS(s)△H1=+571.2kJ•mol-1 ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②
2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②
(1)用过量NaOH溶液吸收气体,得到硫化钠。该反应的离子方程式是________。
(2)反应C(s)+CO2(g) 2CO(g)的△H= ________。
2CO(g)的△H= ________。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看,________;
②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温。
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图所示。
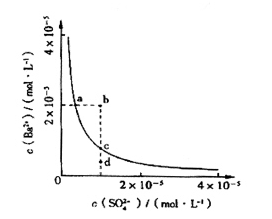
该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+ 使SO42-沉淀完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是________(填序号)。
Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2═2H2O。

请回答:
(5)H+由________极通过固体酸电解质传递到另一极(填a或者b)。
(6)b极上发生的电极反应是 ________。
-
工业上制备BaCl2·H2O有如下两种途径:
途径1:以重晶石(主要成分BaSO4)为原料,流程如下:
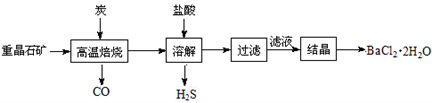
(1)写出“高温焙烧”时反应的化学方程式:____________________________。
(2)“高温焙烧”时必须加入过量的炭,同时还要通入空气,其目的是_______________________。
途径2:以毒重石(主要成分BaCO3,含Ca2+、Mg2+、Fe3+等杂质)为原料,流程如下:
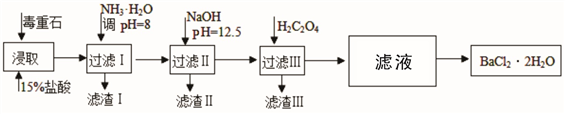
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
(3)过滤Ⅲ所得的滤液经过依次经过_____________,_____________过滤洗涤后得到Bacl2·2H2O(填操作名称)。
(4)加入NH3·H2O调节pH=8可除去____________(填离子符号),滤渣Ⅱ中含_________(填化学式)。加入H2C2O4时应避免过量,原因是________________________。
(5)用BaSO4重量法测定产品纯度的步骤为:
准确称取m g BaCl2•2H2O试样,加入100 mL水,3 mL 2 mol•L-1 的HCl溶液加热溶解。边搅拌,边逐滴加入0.1 mol•L-1 H2SO4溶液。待BaSO4完全沉淀并沉降后,过滤,用0.01 mol•L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。将折叠的沉淀滤纸包置于坩埚中经烘干、炭化、灰化后在800℃灼烧至恒重,称量为n g。则BaCl2·2H2O的质量分数为___________。
-
已知:BaSO4(s) + 4C(s) 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。

回答下列问题:
(1)不溶物A的化学式是_________;若在实验室进行焙烧时,所产生的气体的处理方法是
a.用NaOH溶液吸收 b.用浓硫酸吸收 c.点燃
(2)用单位体积溶液中所含的溶质质量数来表示的浓度叫质量-体积浓度,可以用g/L表示,现用38%的浓盐酸配制含溶质109.5g/L的稀盐酸500mL,所需要的玻璃仪器除了玻璃棒还有________。
(3)沉淀反应中所加的试剂R可以是下列试剂中的________
a.NaOH溶液 b.BaO固体 c.氨水 d.生石灰
证明沉淀已经完全的方法是________________________________________________________。
(4)设计一个实验确定产品氯化钡晶体(BaCl2·nH2O)中的n值,完善下列实验步骤:
①称量样品②_______ ③置于_________(填仪器名称)中冷却 ④称量 ⑤恒重操作。
恒重操作是指_____________________________________________________;
第③步物品之所以放在该仪器中进行实验的原因是。
(5)将重晶石矿与碳以及氯化钙共同焙烧,可以直接得到氯化钡,该反应的化学方程为
BaSO4+ 4C+CaCl2 4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。

(方框内填写操作名称)
-
(15分)已知:BaSO4(s)+4C(s) 高温4CO(g)+BaS(s)
工业上以重晶石矿(主要成分BaSO4,含杂质Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
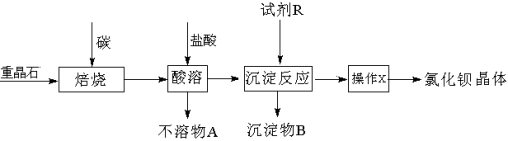
(1)若按以上流程在实验室焙烧重晶石矿,回收处理所产生的气体,恰当的方法是 (填字母编号)。
a.用澄清石灰水吸收气体 b.用浓硫酸吸收气体 c.点燃气体
(2)焙烧重晶石矿时,可能发生的副反应的化学方程式是 (写两个)。
(3)为测定产品氯化钡晶体(BaCl2·nH2O)中的n值,设计下列实验步骤,请补充完善空缺项的实验步骤:①称量样品;②灼烧样品;③置于 (填仪器名称)中冷却;④ ;⑤恒重操作。恒重操作的目的是 ;若最终测出的n值偏大,可能的实验操作误差原因是 (举例一种情况)。
(4)用下列装置组合也可完成(3)中实验。请选择下列恰当的装置组合(称量、加热和夹持仪器省略),完成上述实验: (用装置代号以“A
 ……
…… ”形式表示,每套装置不可重复使用)
”形式表示,每套装置不可重复使用)
(5)将重晶石矿与碳、氯化钙共同焙烧,可以直接得到氯化钡,反应的化学方程式为:
BaSO4+4C+CaCl2高温4CO +CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
+CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。

-
氢氧化钡是分析化学中的重要试剂。工业上以重晶石矿(主要成分BaSO4,含杂质Fe2O3、SiO2)为原料,生产Ba(OH)2·8H2O的流程示意如下:
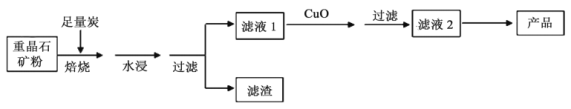
已知:高温焙烧,炭还原重晶石的反应方程式为:BaSO4+4C CO↑+BaS
CO↑+BaS
(1)氢氧化钡的电子式为___________。
(2)水浸并过滤后的滤渣中含三种单质,分别为C、______和____ (填化学式),滤液1显______(填“酸性”或“碱性”)。向滤液1中加入CuO后,会生成黑色沉淀,该反应的化学方程式为___________。
(3)还可采用如下流程对滤液1进行处理:
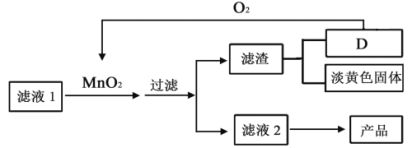
若D物质为AB型,其组成与MnO2相同,滤液1中加入MnO2的化学方程式为_______。该方法的优点是_____。
(4)由滤液2得到产品需采用的操作是___________、___________、过滤。




















