-
工业上制备BaCl2·H2O有如下两种途径:
途径1:以重晶石(主要成分BaSO4)为原料,流程如下:
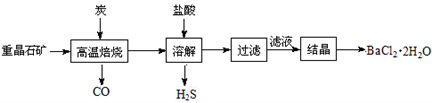
(1)写出“高温焙烧”时反应的化学方程式:____________________________。
(2)“高温焙烧”时必须加入过量的炭,同时还要通入空气,其目的是_______________________。
途径2:以毒重石(主要成分BaCO3,含Ca2+、Mg2+、Fe3+等杂质)为原料,流程如下:
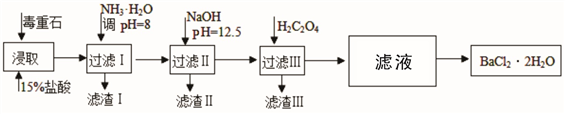
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
(3)过滤Ⅲ所得的滤液经过依次经过_____________,_____________过滤洗涤后得到Bacl2·2H2O(填操作名称)。
(4)加入NH3·H2O调节pH=8可除去____________(填离子符号),滤渣Ⅱ中含_________(填化学式)。加入H2C2O4时应避免过量,原因是________________________。
(5)用BaSO4重量法测定产品纯度的步骤为:
准确称取m g BaCl2•2H2O试样,加入100 mL水,3 mL 2 mol•L-1 的HCl溶液加热溶解。边搅拌,边逐滴加入0.1 mol•L-1 H2SO4溶液。待BaSO4完全沉淀并沉降后,过滤,用0.01 mol•L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。将折叠的沉淀滤纸包置于坩埚中经烘干、炭化、灰化后在800℃灼烧至恒重,称量为n g。则BaCl2·2H2O的质量分数为___________。
-
工业上制备 BaCl2·2H2O 有如下两种途径。
途径 1:以重晶石(主要成分 BaSO4)为原料,流程如下:

(1)写出“高温焙烧”时反应的化学方程式: _____________________________________。
(2)“高温焙烧” 时必须加入过量的炭,同时还要通入空气,其目的是____________。
途径 2:以毒重石(主要成分 BaCO3,含 Ca2+、 Mg2+、 Fe3+等杂质)为原料,流程如下:

已知: Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
(3)为提高矿石的浸取率,可采取的措施是_________。
(4)加入 NH3·H2O 调节 pH=8 可除去____ (填离子符号),滤渣Ⅱ中含_________(填化学式)。加入 H2C2O4时应避免过量,原因是_________。
(5)重量法测定产品纯度的步骤为:
准确称取 m g BaCl2·2H2O 试样,加入 100 mL 水, 用 3 mL 2 mol·L-1 的 HCl 溶液加热溶解。边搅拌,边逐滴加入 0.1 mol·L-1 H2SO4 溶液。待 BaSO4 完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含 Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为 n g。则BaCl2·2H2O的质量分数为_________。
-
工业上制备 BaCl2·2H2O有如下两种途径。
途径 1:以重晶石(主要成分BaSO4)为原料,流程如下:
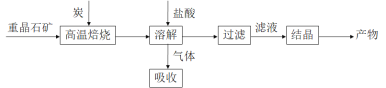
(1)写出“高温焙烧”时反应的化学方程式:_____________________________________。
(2)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为_____________。
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
途径 2:以毒重石(主要成分BaCO3,含Ca2+、Mg2+、Fe3+等杂质)为原料,流程如下:
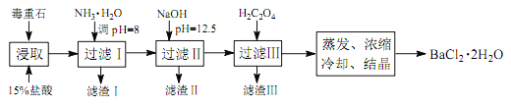
已知:Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
(4)为提高矿石的浸取率,可采取的措施是_________。
(5)加入 NH3·H2O 调节 pH=8 可除去___________(填离子符号),滤渣Ⅱ中含_________(填化学式)。加入 H2C2O4时应避免过量,原因是_________。
(6)重量法测定产品纯度的步骤为:准确称取 m g BaCl2·2H2O试样,加入100 mL水, 用3 mL 2 mol·L-1 的 HCl溶液加热溶解。边搅拌,边逐滴加入0.1 mol·L-1 H2SO4 溶液。待BaSO4完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为n g。则BaCl2·2H2O的质量分数为_________。
(7)20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g·L-1)如图所示。下列叙述正确的是_______________
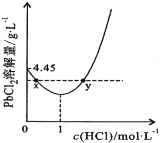
A.盐酸浓度越大,Ksp(PbCl2)越大
B.PbCl2能与一定浓度的盐酸反应
C.x、y两点对应的溶液中c(Pb2+)相等
D.往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)
-
氯化钡是白色的晶体,易溶于水,微溶于盐酸和硝酸,难溶于乙醇和乙醚,易吸湿,需密封保存。工业上制备BaCl2·2H2O有如下两种途径:
途径1:以重晶石(主要成分BaSO4)为原料,流程如下:
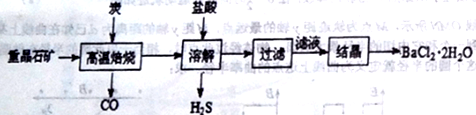
(1)写出“溶解”时反应的化学方程式方程式:________________________。
(2)“高温焙烧”时必须加入过量的炭,同时还要通入空气,其目的是_____________。
(3)结晶得到的晶体,需用乙醇洗涤的理由是_______________________。
途径2:以毒重石(主要成分BaCO3,含CaCO3、MgCO3、Fe2O3、SiO2等杂质)为原料,流程如下:
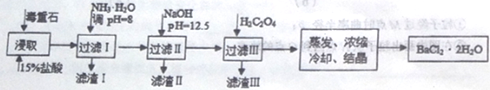
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,Ksp[Mg(OH)2]=1.8×10-11。
| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
(4)滤渣I的成分为________(填化学式)。
(5)滤渣II中含_________(填化学式)。过滤析出后,滤液中含有的Mg2+浓度为_______。
(6)加入H2C2O4时应避免过量,其原因是为了防止生成______(填化学式)。
-
氢氧化钡是分析化学中的重要试剂。工业上以重晶石矿(主要成分BaSO4,含杂质Fe2O3、SiO2)为原料,生产Ba(OH)2·8H2O的流程示意如下:
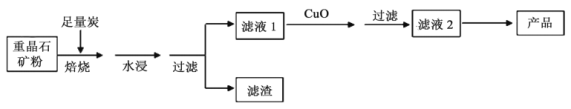
已知:高温焙烧,炭还原重晶石的反应方程式为:BaSO4+4C CO↑+BaS
CO↑+BaS
(1)氢氧化钡的电子式为___________。
(2)水浸并过滤后的滤渣中含三种单质,分别为C、______和____ (填化学式),滤液1显______(填“酸性”或“碱性”)。向滤液1中加入CuO后,会生成黑色沉淀,该反应的化学方程式为___________。
(3)还可采用如下流程对滤液1进行处理:
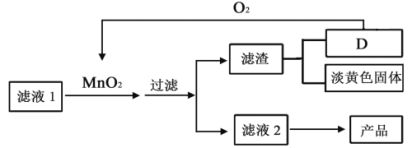
若D物质为AB型,其组成与MnO2相同,滤液1中加入MnO2的化学方程式为_______。该方法的优点是_____。
(4)由滤液2得到产品需采用的操作是___________、___________、过滤。
-
硫酸盐在生产生活中有广泛应用。
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如下:
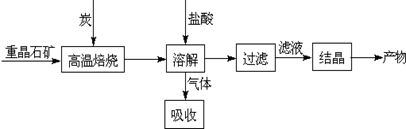
某研究小组查阅资料得:
BaSO4(s)+4C(s) 4CO(g)+BaS(s)△H1=+571.2kJ•mol-1 ①
4CO(g)+BaS(s)△H1=+571.2kJ•mol-1 ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②
2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②
(1)用过量NaOH溶液吸收气体,得到硫化钠。该反应的离子方程式是________。
(2)反应C(s)+CO2(g) 2CO(g)的△H= ________。
2CO(g)的△H= ________。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看,________;
②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温。
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图所示。
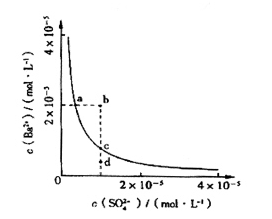
该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+ 使SO42-沉淀完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是________(填序号)。
Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2═2H2O。

请回答:
(5)H+由________极通过固体酸电解质传递到另一极(填a或者b)。
(6)b极上发生的电极反应是 ________。
-
以重晶石(主要成分为BaSO4)为主要原料制备立德粉(ZnS和BaSO4的混合物)的工艺流程如下:
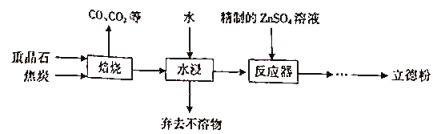
(1)焙烧(温度为1000~2000)时,焦炭需过量,其目的是____________________。
(2)焙烧过程中发生的反应之一是4CO+BaSO4 BaS+4CO2,该反应的氧化剂与还原剂的物质的量之比为_________________,还原产物是___________。
BaS+4CO2,该反应的氧化剂与还原剂的物质的量之比为_________________,还原产物是___________。
(3)反应器中发生反应的化学方程式为______________________。
(4)流程中所需的精制的ZnsO,溶液的制取方法是:首先用工业级氧化锌(含少量FeO和Fe2O3杂质)和稀硫酸反应制取粗硫酸锌溶液,然后向粗硫酸锌溶液中先后加入H2O2溶液和碳酸锌精制。
①加入H2O2溶液时发生反应的离子方程式为______________________。
②加入碳酸锌的目的是________________,反应的化学方程式为_____________________。
-
以重晶石(主要成分为BaSO4)为主要原料制备立德粉(ZnS和BaSO4的混合物)的工艺流程如下:
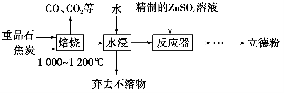
(1)焙烧时,焦炭需过量,其目的是:①____________________________;②____________________________。
(2)焙烧过程中发生的反应之一是4CO(g)+BaSO4(s) BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
反应器中发生反应的化学方程式为____________________________________。
(4)用工业级氧化锌(含少量FeO和Fe2O3杂质)和硫酸制取硫酸锌溶液时,需先后加入H2O2溶液和碳酸锌精制,加入H2O2溶液时发生反应的离子方程式为
________________________________,加入碳酸锌的目的是将溶液中的Fe3+转化为红褐色沉淀,写出该反应的化学方程式:__________________________________________。
-
以重晶石(主要成分为BaSO4)为主要原料制备立德粉(ZnS和BaSO4的混合物)的工艺流程如下:
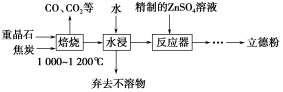
(1)焙烧时,焦炭需过量,其目的是:①_______________②_________________。
(2)焙烧过程中发生的反应之一是4CO(g)+BaSO4(s) BaS(s)+4CO2(g),该反应的平衡常数的表达式为_________________________。
BaS(s)+4CO2(g),该反应的平衡常数的表达式为_________________________。
(3)反应器中发生反应的化学方程式为_______________________。
(4)用工业级氧化锌(含少量FeO和Fe2O3杂质)和硫酸制取硫酸锌溶液时,需先后加入H2O2溶液和碳酸锌精制,加入H2O2溶液时发生反应的离子方程式为___________________,加入碳酸锌的目的是将溶液中的Fe3+转化为红褐色沉淀,写出该反应的化学方程式:____________________。
-
(13分)工业上用重晶石(BaSO4)制备其他钡盐的常用方法主要有高温煅烧还原法、沉淀转化法等。
I.高温煅烧还原法
工业上利用重晶石高温煅烧还原法制备BaCl2的工艺流程图如下:
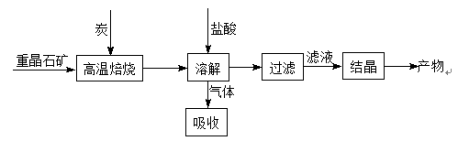
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 = + 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 = + 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2 = + 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2 = + 226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为: 。
(2)反应C(s) + CO2(g) 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的可能是 。
II.沉淀转化法
(4)已知KSP(BaSO4) =1.0×10-10,KSP(BaCO3)=2.5×10-9。某同学设想用饱和Na2CO3溶液和盐酸将BaSO4转化成BaCl2,若用10 L Na2CO3溶液一次性溶解并完全转化1.0 mol BaSO4(溶液体积变化可忽略不计), 则该转化过程的离子方程式为 ; 反应的平衡常数K= ;Na2CO3溶液的最初浓度不得低于 。

















