-
明代名臣于谦作诗“凿开混沌得乌金,藏蓄阳和意最深。爝火燃回春浩浩,洪炉照破夜沉沉……”,诗中所写“乌金”是
A. 焦炭 B. 煤炭 C. 磁铁矿 D. 软锰矿
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法不正确的是
A. 标准状况下3.6 g H2O含有的电子数为2NA
B. 2.8 g乙烯与聚乙烯的混合物含有的极性键为0.4NA
C. 0.l moI Cl2与足量的铁粉充分反应转移的电子数为0.2NA
D. 1 L 0.2 mol/l的K2Cr207溶液中Crz072—的数目为0.2NA
难度: 简单查看答案及解析
-
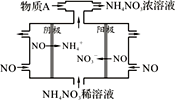
近年来,尿素电氧化法处理富含尿素的工业废水和生活污水得到了广泛关注,该法具有操作简易、处理量大、运行周期长等优点,且该过程在碱性条件下产生无毒的C02、N2。电池工作时,下列说法错误的是
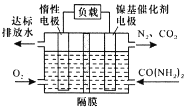
A. 负极发生的反应为:CO(NH2)2+6OH——6e—=N2↑+CO2↑+5H2O
B. 正极附近溶液的pH增大
C. 隔膜只允许阳离子通过
D. 处理掉废水中尿素1.0g时消耗O2 0.56L(标准状况)
难度: 中等查看答案及解析
-
从薄荷中提取的薄荷醇可制成医药。薄荷醇的结构简式如下图,下列说法正确的是
A. 薄荷醇分子式为C10H20O,它是环己醇的同系物
B. 薄荷醇的分子中至少有12个原子处于同一平面上
C. 薄荷醇在Cu或Ag做催化剂、加热条件下能被O2氧化为醛
D. 在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应
难度: 简单查看答案及解析
-
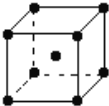
有X、Y、Z、W是4种原子序数依次增大的短周期元素,其中X原子在元素周期表中原子半径最小,Y、Z位于同一主族,Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是
A. 元素非金属性:Z<X<Y B. 原子半径:W>Z>Y
C. 0.1mol/L溶液pH:X2Z<XW D. Z2W2中各原子都达到稳定结构,其电子式是
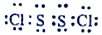
难度: 中等查看答案及解析
-
常温下,用0.05mol/LNaOH溶液分别滴定10.00mL浓度均为0.10 mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲线如图。下列说法正确的是
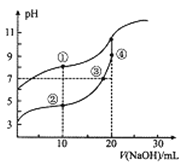
A. 对两种弱酸滴定均可选用甲基橙作指示剂
B. ③处溶液有:c(Na+)=c(CH3COO-)<c(CH3COOH)
C. 溶液中水的电离程度:②>③>④
D. 点①和点②溶液混合后:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
难度: 中等查看答案及解析
-
下列实验过程可以达到实验目的的是
编号
实验目的
实验过程
A
配制0.4000 mol/L的NaOH溶液
称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容
B
探究维生素C的还原性
向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
C
制取并纯化氢气
向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓盐酸和KMnO4溶液
D
探究浓度对反应速率的影响
向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象
A. A B. B C. C D. D
难度: 中等查看答案及解析
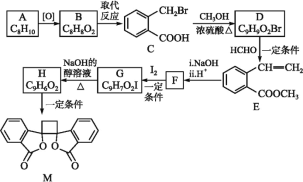

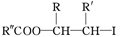 ;ⅲ.R—HC=CH—R'
;ⅲ.R—HC=CH—R'