-
下列物质的水溶液因水解而呈碱性的是
A.NaCl B.NH4Cl C.NaHCO3 D.NaOH
难度: 简单查看答案及解析
-
一定条件下,某反应达到化学平衡时,下列说法错误的是( )
A. 正反应速率等于逆反应速率 B. 各物质的浓度不再改变
C. 反应停止了 D. 该反应达到最大限度
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.化学平衡向正向移动,反应物浓度一定降低
B.化学平衡向正向移动,生成物的浓度一定增加
C.化学平衡向正向移动,反应物的转化率一定增大
D.化学平衡向正向移动时,正反应速率一定大于逆反应速率
难度: 简单查看答案及解析
-
在2A+B⇌3C+4D中,表示该反应速率最快的是( )
A. v(A)=0.7mol•L﹣1•S﹣1
B. v(B)=0.3 mol•L﹣1•S﹣1
C. v(C)=0.8mol•L﹣1•S﹣1
D. v(D)=1 mol•L﹣1•S﹣1
难度: 中等查看答案及解析
-
火箭推进器常以联氨(N2H4) 为燃料、过氧化氢为助燃剂.已知下列各物质反应的热化学方程式: N2H4(g)+O2(g)=N2(g)+2H2O(g)△H1=﹣533.23kJ•mol﹣1;H2O(g)=H2O (l)△H2=﹣44kJ•mol﹣1;2H2O2(l)=2H2O(l)+O2(g)△H3=﹣196.4kJ•mol﹣1则联氨与过氧化氢反应的热化学方程式可表示为( )
A. N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=+817.63 kJ•mol﹣1
B. N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.63 kJ•mol﹣1
C. N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=﹣641.63 kJ•mol﹣1
D. N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣817.63 kJ•mol﹣1
难度: 中等查看答案及解析
-
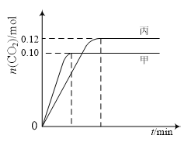
一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
容器
温度/℃
起始物质的量/mol
NO (g)
CO (g)
甲
T1
0.20
0.20
乙
T1
0.30
0.30
丙
T2
0.20
0.20
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%
难度: 中等查看答案及解析
-
光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:
据此,下列判断中正确的是( )
A.该溶液中存在着SO2分子
B.该溶液中H+浓度是SO32-浓度的2倍
C.向该溶液中加入足量的酸都能放出SO2气体
D.向该溶液中加入过量NaOH可得到Na2SO3、NaHSO3和NaOH的混合溶液
难度: 简单查看答案及解析
-
下列说法正确的是:
A. 在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g)
H2O(l) 的ΔH =" 40.69" kJ·mol-1
B. 已知MgCO3的Ksp =" 6.82" × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-) =" 6.82" × 10-6
C. 已知:
则可以计算出反应
的ΔH为-384 kJ·mol-1
D. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
难度: 中等查看答案及解析
-
现有mA (s) + nB (g)
pC (g)(正反应放热)的可逆反应,在一定温度下平衡时B的体积分数和压强间的关系如图所示,则有关该反应的下列描述中正确的是( )
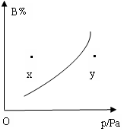
A.m+n<p
B.n<p
C.x点的混合物中v正>v逆
D.x点比y点的混合物正反应速度大
难度: 困难查看答案及解析
-
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)
CO(g)+3H2(g)。设起始
=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是

A. 该反应的焓变 △H>0
B. 图中Z的大小为 a>3>b
C. 图中X点对应的平衡混合物中
=3
D. 温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
难度: 简单查看答案及解析
-
H2O2分别在无催化剂、催化剂M和N作用下分解,其能量随反应进程的变化如下图所示。有关2H2O2(l)= 2H2O(l)+O2(g) ΔH 的下列说法正确的是
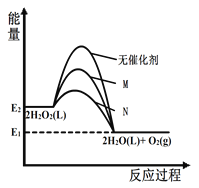
A.ΔH= E2-E1
B.实验中,M催化效率低于N
C.加入催化剂M、N,降低了反应的ΔH
D.在无催化剂时,该反应历程活化能最低
难度: 中等查看答案及解析
-
下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色走变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D. 黄绿色的氯水光照后颜色变浅
难度: 中等查看答案及解析
-
常温下,向20.00 mL 0.1000 mol·L—1(NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
A. 点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B. 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C. 点c所示溶液中:c(SO42-)+ c(H+)= c(NH3·H2O )+ c(OH-)
D. 点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+)
难度: 困难查看答案及解析
-
氢气是21世纪极有前途的新型能源,是各国研究的热点之一。氢能开发的首要问题是研究如何以水为原料制取氢气。以下研究方向中你认为可行的是( )
A. 大量建设水电站,用电力分解水制取氢气
B. 设法将太阳能聚焦,产生高温,使水分解产生氢气
C. 寻找更多的化石燃料,利用其燃烧放热,使水分解产生氢气
D. 寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
难度: 简单查看答案及解析
-
下列有关电解质溶液的叙述正确的是
A. 室温下,pH均为4的H2SO4、(NH4)2SO4的溶液中,水的电离程度相同
B. 室温时,Ka=1×10-5浓度为0.1 mol/L的HA溶液,pH≈3
C. 在饱和AgCl、AgBr的混合溶液中加入少量AgNO3溶液
增大
D. 25℃时,向20 mL 0.01 mol/L的醋酸溶液中滴加10 mL 0.01 mol/L的KOH溶液,混合溶液后呈酸性:c(K+) + c(H+)<c(CH3COOH) + c(OH-)
难度: 困难查看答案及解析
-
少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的 ( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)
A. ①⑥⑦ B. ③⑤ C. ③⑦ D. ⑤⑦
难度: 中等查看答案及解析
-
温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号
物质的起始浓度(mol·L-1)
物质的平衡浓度(mol·L-1)
c(NO2)
c(NO)
c(O2)
c(O2)
I
0.6
0
0
0.2
II
0.3
0.5
0.2
Ⅲ
0
0.5
0.35
A. 达平衡时,容器I与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器中Ⅱ中 c(O2)/ c(NO2) 比容器I中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为 T2时,若 k正=k逆,则 T2<T1
难度: 困难查看答案及解析
-
一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g)
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3 mol·L-1,则下列叙述正确的是
A. 平衡向正反应方向移动 B. x+y<z
C. C 的体积分数降低 D. B的转化率提高
难度: 中等查看答案及解析
-
已知反应2CO(g)===2C(s)+O2(g)的ΔH为正值,ΔS为负值。设ΔH和ΔS不随温度的改变而改变。则下列说法中,正确的是( )
A. 低温下是自发变化 B. 高温下是自发变化
C. 低温下是非自发变化,高温下是自发变化 D. 任何温度下是非自发变化
难度: 中等查看答案及解析
-
关于相同体积pH均为3的醋酸和盐酸,下列说法正确的是
A. 稀释10倍后,两者的pH变化醋酸大于盐酸
B. 中和相同浓度的氢氧化钠溶液,消耗氢氧化钠的物质的量盐酸大于醋酸
C. 加入一定量的锌粉,产生气体的体积相同,则醋酸一定过量
D. 加入足量的锌粉,产生氢气的速率随时间的变化如图所示
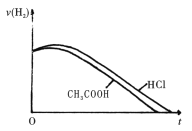
难度: 简单查看答案及解析
-
已知lg2=0.3010,Ksp[Mn(OH)2]=2.0×10 ─13。实验室制氯气的废液中含c(Mn2+)=0.1 mol•L-1,向该溶液中滴加稀氢氧化钠溶液至Mn2+完全沉淀的最小pH等于( )。
A. 8.15 B. 9.3
C. 10.15 D. 11.6
难度: 困难查看答案及解析
-
下列事实中不能用平衡移动原理解释是( )
A. 密闭、低温是存放氨水的必要条件
B. 实验室常用排饱和食盐水法收集氯气
C. 打开汽水瓶时,有大量气泡冒出
D. 已知合成氨的反应为N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4 kJ/mol,工业上采用较高温度和使用催化剂以提高氨气的产率
难度: 中等查看答案及解析
-
下到有关电解质溶液的说法不正确的是( )
A. 向Na2CO3溶液中通入NH3,
减小
B. 将0.1mol·L-1的K2C2O4溶液从25℃升温至35℃,
增大
C. 向0.1mol·L-1的HF溶液中滴加NaOH溶液至中性,
=1
D. 向0.1mol·L-1的CH3COONa溶液中加入少量水,
增大
难度: 中等查看答案及解析
-
恒温密闭容器发生可逆反应:Z(?)+W(?)
X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是
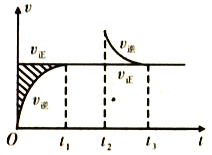
A. Z和W在该条件下有一种可能为气态
B. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等。
C. 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
D. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
难度: 中等查看答案及解析