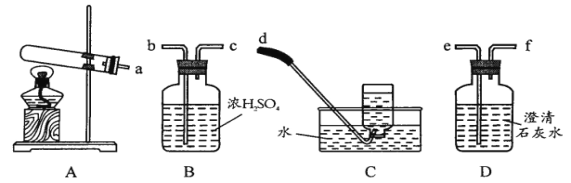
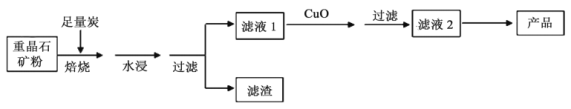
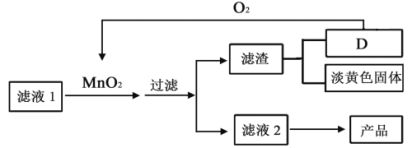
-
化学与社会、生活、技术密切相关。下列相关说法正确的是
A. 二氧化硅是太阳能电池板的主要材料,太阳能替代化石燃料有利于节约资源、保护环境
B. ClO2代替Cl2作消毒剂,不仅能够提高消毒效率,而且可以避免产生新的有害物质
C. 玉米、稻谷、大豆等农产品不仅富含天然有机高分子化合物,而且是重要的酿酒原料
D. “刀耕火耨”描述我国远古时期利用草木灰作肥料,该肥料宜与磷酸铵混合施用
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列叙述正确的是
A. 0.1 mol C2H5OH分子中含C-H键数为0.6NA
B. 由H218O与D216O组成的2.0 物质所含中子数为NA
C. 25 ℃,1 L pH=13的Ba(OH)2溶液中OH-数为0.2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
难度: 中等查看答案及解析
-
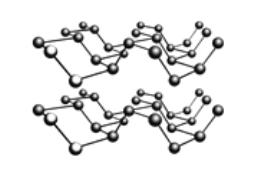
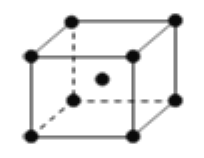
立体烷烃中有一系列对称结构的烷烃,如:
(正四面体烷C4H4)、
(棱晶烷C6H6)、
立方烷C8H8)等,下列有关说法错误的是
A. 以此类推分子式为C12H12的立体烷烃的结构应为正六棱柱
B. 上述一系列物质互为同系物,它们的通式为C2nH2n(n≥2)
C. 棱晶烷与立方烷中碳原子均为饱和碳原子,其二氯代物都有三种
D. 苯乙烯(
)、环辛四烯(
)与立方烷属于同分异构体
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、R、Q原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的0.1mol/L水溶液pH如下表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是

A. W和Q形成的化合物只含有离子键
B. Y和Z的氢化物沸点:Y<Z
C. 离子半径:r(Q>r(R)>r(Z)
D. Y和Q氧化物的水化物酸性:Q>Y
难度: 中等查看答案及解析
-
在电镀车间的含铬酸性废水中,铬的存在形式有Cr(Ⅵ)和Cr(Ⅲ)两种,其中以Cr(Ⅵ)的毒性最大。电解法处理含铬废水如图,铬最终以Cr(OH)3沉淀除去。下列说法正确的是
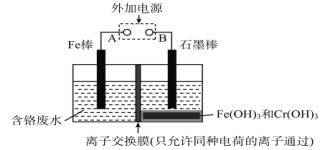
A. Fe为阳极,反应为Fe-2e-=Fe2+
B. 阴极反应为Cr2O72-+7H2O+6e-=2Cr(OH)3↓+8OH-
C. 阳极每转移3mol电子,可处理Cr(Ⅵ)物质的量为1mol
D. 离子交换膜为质子交换膜,只允许H+穿过
难度: 中等查看答案及解析
-
已知:pCu=-1gc(Cu+),pX=-lgc(X-)。298K时,Ksp(CuCl)=a×10-6,Ksp(CuBr)=b×10-9,Ksp(CuI)=c×10-12。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是
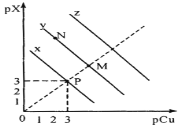
A. 298K时,在CuCl的饱和溶液中加入少量NaCl,c(Cu+)和c(Cl-)都减小
B. 图中x代表CuI曲线,且P点c(Cu+)=c(I-)
C. 298K时增大M点的阴离子浓度,则y上的点向N点移动
D. 298K时CuBr(s)+I-(aq)
CuI(s)+Br-(aq)的平衡常数K的数量级为103或102
难度: 中等查看答案及解析