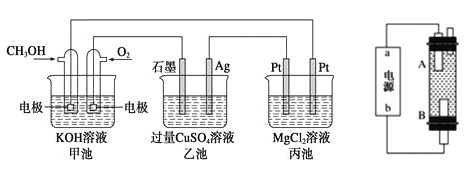
-
下列说法不正确的是( )
A. 化学反应中一定伴随能量变化
B. 甲烷燃烧是将全部的化学能转化为热能
C. 物质所含化学键键能越大,其越稳定
D. 大量燃烧煤炭等化石燃料是造成雾霾天气的重要原因
难度: 简单查看答案及解析
-
由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )
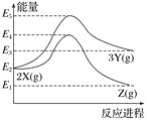
A. 由 X→Z 反应的 ΔH<0
B. 由 X→Y 反应的 ΔH=E5-E2
C. 增大压强有利于提高 Y 的产率
D. 升高温度有利于提高 Z 的产率
难度: 中等查看答案及解析
-
在通常条件下,下列各组物质的性质排列正确的是( )
A. Na、Mg、Al 的第一电离能逐渐增大 B. O、 F、 N 的电负性逐渐增大
C. S2﹣、 Cl﹣、 K+的半径逐渐增大 D. 热稳定性: HF>H2O>NH3
难度: 中等查看答案及解析
-
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
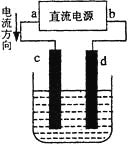
A. a为负极、b为正极 B. a为阳极、b为阴极
C. 电解过程中,d电极质量增加 D. 电解过程中,氯离子浓度不变
难度: 简单查看答案及解析
-
一定温度下,在恒容密闭容器中发生反应X(g)+2Y(g)
2Z(g)。下列叙述能判断该反应达到化学平衡的是
① X、Y、Z的物质的量之比是1∶2∶2 ② X、Y、Z的浓度不再发生变化③ 容器中的压强不再发生变化 ④ 单位时间内生成n mol Z,同时消耗n mol Y
A. ①② B. ①④ C. ②③ D. ③④
难度: 简单查看答案及解析
-
在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。常 温时下列有关说法中正确的是
A. FeS的溶解度大于CuS的溶解度
B. 饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
C. 向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D. 向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
难度: 简单查看答案及解析
-
下列事实可以证明一水合氨是弱电解质的是
①室温下,
的氨水可以使酚酞试液变红②室温下,
的氯化铵溶液的PH约为5
③在相同条件下,氨水溶液的导电性比强碱溶液弱④铵盐受热易分解
A. ①② B. ②③ C. ③④ D. ②④
难度: 简单查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A. 已知
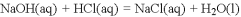
,则
固体与稀盐酸完全反应,放出的热量即为
B. 已知
则
C. 已知
 ,则反应物总能量小于生成物总能量
,则反应物总能量小于生成物总能量D. 已知
(白磷,s)=
(红磷,s)
,则白磷比红磷稳定
难度: 简单查看答案及解析
-
现用0.1mol/L的HCl溶液滴定10mL0.05mol/L的NaOH溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是
A. 10mL B. 5mL C. 大于5mL D. 小于5mL
难度: 简单查看答案及解析
-
25℃时,下列各组离子在指定溶液中可能大量共存的是
A. 无色溶液中:NH4+、Cu2+、CO32-、Cl-
B. 中性溶液中可能大量存在Na+、Ba2+、Cl-、NO3-
C. pH值为1的溶液:Na+、Al3+、CH3COO-、SO42-
D. 由水电离的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、K+、HCO3-、Br-
难度: 简单查看答案及解析
-
在0.1 mol·L-1氨水中存在如下电离平衡:NH3·H2O
NH4++OH-,对于该平衡,下列叙述正确的是
A. 加入水时,溶液中c(OH-) 增大
B. 加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小
C. 通入少量HCl气体,溶液中c(NH4+)增大
D. 降低温度,促进NH3·H2O电离
难度: 简单查看答案及解析
-
已知HCN为弱酸,在0.1mol·L-1的KCN溶液中,下列关系不正确的是
A. c(K+)>c(CN-) B. c(CN-)>c(HCN)
C. c(HCN)+c(CN-)=0.2mol·L-1 D. c(K+)+c(H+)=c(CN-)+c(OH-)
难度: 简单查看答案及解析