-
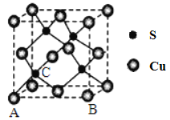
下列描述中正确的是
A. ClO3—的空间构型为平面三角形 B. SF6的中心原子有6对成键电子对,无孤电子对
C. BF3和PCl3的中心原子均为sp2杂化 D. BeCl2和SnCl2的空间构型均为直线形
难度: 中等查看答案及解析
-
少量铁粉与100mL 0.01mol•L﹣1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CuO固体 ⑤加NaCl溶液 ⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 0.1mol•L﹣1的盐酸
A. ①⑤⑦ B. ③⑦⑧ C. ②④⑥ D. ③⑥⑦⑧
难度: 简单查看答案及解析
-
下列对一些实验事实的解释正确的是
选项
实验事实
解释
A
水加热到较高温度都难以分解
水分子间存在氢键
B
白磷为正四面体分子
白磷分子中P-P键间的键角是109°28′
C
用苯萃取碘水中的I2
苯和I2均为非极性分子,且苯与水互不相溶
D
H2O的沸点高于H2S
H-O键的键长比H-S键的键长短
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关能源的说法不正确的是
A. 光电转换的基本装置就是太阳能电池,应用相当广泛
B. 我国南海“可燃冰”,可能成为替代化石燃料的新能源
C. 贮氢合金的发现和应用,开辟了解决氢气贮存、运输难题的新途径
D. 天然气、液化石油气、氢能是可再生的清洁能源
难度: 简单查看答案及解析
-
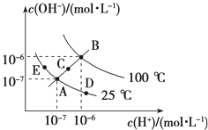
室温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红的溶液:Na+、I-、NO3-、SO42-
B. pH=12的溶液中:CO32-、Na+、NO3-、S2-、SO32-
C. 水电离H+浓度c(H+)=10-12 mol/L-1溶液中:Cl-、CO32-、NO3-、NH4+、SO32-
D. 加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1 L1 mol·L-1HCl溶液中含有NA个HCl分子
C. 12.0 g熔融的NaHSO4中含有的阳离子数为0.1NA
D. 1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2 NA个电子
难度: 中等查看答案及解析
-
室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
难度: 中等查看答案及解析
-
25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是
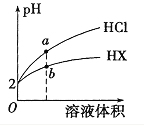
A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b
C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3
难度: 中等查看答案及解析