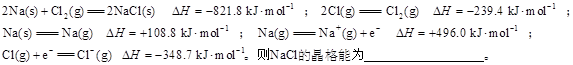-
按要求回答下列问题:
(1)在200℃、101kPa时,0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,该反应的热化学方程式表示为____。
(2)根据键能数据估算
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
CH4(g)+4F2(g) =CF4(g)+4HF(g)的反应热ΔH为______kJ/mol
(3) 已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 则:反应①中,ΔS______(选填“>”、“<”或“=”)0;
2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。
-
按要求回答下列问题:
Ⅰ.(1)在200℃、101kPa时,0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,该反应的热化学方程式表示为________________________。
(2)已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 则:反应①中,ΔS______(选填“>”、“<”或“=”)0;2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。
Ⅱ.已知水的电离平衡曲线如图所示,试回答下列问题:
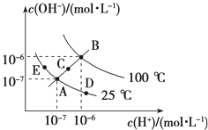
(3)图中五点KW间的关系是__________________.
(4)若从A点到D点,可采用的措施是________.
a.升温 b.加入少量的NaOH c.加入少量的NH4Cl
(5)E对应的温度下,在pH=9的NaOH溶液与pH=4的H2SO4 溶液中,水电离出的H+浓度之比为:________,若将两溶液混合所得溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
-
(6分)按要求回答下列问题:
(1)已知在200℃,101kPa时,H2与碘蒸气作用生成1mol HI放出7.45kJ热量,则该反应的热化学方程式为________。
(2)太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下使某种盐熔化,吸收热量,晚间熔盐固化释放出相应能量。已知下列数据:
| 序号 | 盐 | 熔点/℃ | 熔化热/ | 参考价格/ |
| ① | CaCl2·6H2O | 29.0 | 37.3 | 780~850 |
| ② | Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
| ③ | Na2HPO4·12H2O | 36.1 | 100.1 | 1800~2400 |
| ④ | Na2SiO3·5H2O | 52.5 | 49.7 | 1400~1800 |
其中最适宜作为储能介质的是________。(选填物质序号)
(3)离子晶体晶格能的定义是气态离子形成1mol离子晶体释放的能量,通常取正值。现已知:
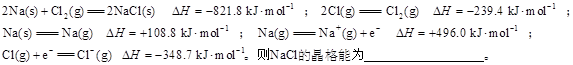
-
下列说法正确的是( )
A.所有反应的反应热都可以由实验直接测定
B.任何化学反应都需要用活化能来引发
C.200ºC、101KPa时,1g氢气与碘蒸气作用生成HI气体,放出7.45kJ热量,则此过程的热化学方程式可表示为:
D.物质发生化学变化都伴随着能量变化
-
200℃、101kPa时,在密闭容器中充入1molH2和1molI2,发生反应I2(g)+H2(g) 2HI(g) ΔH=-14.9 kJ/mol。反应一段时间后,能说明反应已经达到化学平衡状态的是
2HI(g) ΔH=-14.9 kJ/mol。反应一段时间后,能说明反应已经达到化学平衡状态的是
A. 放出的热量小于14.9 kJ
B. 反应容器内压强不再变化
C. HI生成的速率与HI分解的速率相等
D. 单位时间内消耗a mol H2,同时生成2a mol HI
-
200℃、101kPa时,在密闭容器中充入1molH2和1molI2,发生反应I2(g)+H2(g) 2HI(g) ΔH=-14.9 kJ/mol。反应一段时间后,能说明反应已经达到化学平衡状态的是
2HI(g) ΔH=-14.9 kJ/mol。反应一段时间后,能说明反应已经达到化学平衡状态的是
A.放出的热量小于14.9 kJ
B.反应容器内压强不再变化
C.HI生成的速率与HI分解的速率相等
D.单位时间内消耗a mol H2,同时生成2a mol HI
-
在101kPa时,0.5molCH4完全燃烧生成CO2和液态H2O放出495.2kJ的热量,写出该反应的热化学方程式。________.
-
胶状液氢(主要成分是H2和CH4)有希望用于未来的运载火箭和空间运输系统。实验测得:101 kPa时,1 molH2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2放出890.3 kJ的热量。下列热化学方程式书写正确的是( )
A. CH4(g)+2O2(g)=CO2(g)+2H2O(l)  H=+890.3kJ·mol-1
H=+890.3kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l)  H= - 890.3 kJ·mol-1
H= - 890.3 kJ·mol-1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l)  H=890.3 kJ
H=890.3 kJ
D. 2H2(g)+O2(g)=2H2O(l)  H=-285.8 kJ·mol-1
H=-285.8 kJ·mol-1
-
下列说法正确的是
A.在101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol
B.在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧热为
—285.8kJ/mol
C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度
D.在稀溶液中:H+(aq) + OH--(aq) === H2O(l);△H= —57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ
-
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8molH2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为_____________________。
(2)已知H2O(l) = H2O(g) ΔH= +44kJ/mol。
则16g液态肼与液态双氧水反应生成液态水时放出的热量是_________________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是____________________________。