-
结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
实验序号
①
②
加入试剂
4 mL 0.01mol/L酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
4 mL 0.01mol/L酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
一粒黄豆粒大的MnSO4固体
褪色时间/s
116
6
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)该实验结论是___________________________________________________________。
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________。
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为_____。
实验序号
③
加入试剂
4 mL 0.01mol/L酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
一粒黄豆粒大的Na2SO4固体
褪色时间/s
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级
一级
配料
食盐、碘酸钾(KIO3)、抗结剂
碘含量(以I计)
20~50 mg·kg-1
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用_________,恰好完全反应时的现象是_______________。
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________(填“偏高”、“偏低”或“没有影响”)。
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)________mg·kg-1(计算结果保留整数即可)。
高二化学综合题中等难度题查看答案及解析
-
结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
实验序号
①
②
加入试剂
4 mL 0.01mol/L酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
4 mL 0.01mol/L酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
一粒黄豆粒大的MnSO4固体
褪色时间/s
116
6
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)该实验结论是___________________________________________________________。
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________。
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为_____。
实验序号
③
加入试剂
4 mL 0.01mol/L酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
一粒黄豆粒大的Na2SO4固体
褪色时间/s
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级
一级
配料
食盐、碘酸钾(KIO3)、抗结剂
碘含量(以I计)
20~50 mg·kg-1
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用_________,恰好完全反应时的现象是_______________。
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________(填“偏高”、“偏低”或“没有影响”)。
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)________mg·kg-1(计算结果保留整数即可)。
高二化学综合题中等难度题查看答案及解析
-
结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
实验序号
①
②
加入试剂
4 mL 0.01mol/L酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
4 mL 0.01mol/L酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
一粒黄豆粒大的MnSO4固体
褪色时间/s
116
6
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)该实验结论是___________________________________________________________。
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________。
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为_____。
实验序号
③
加入试剂
4 mL 0.01mol/L酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
一粒黄豆粒大的Na2SO4固体
褪色时间/s
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级
一级
配料
食盐、碘酸钾(KIO3)、抗结剂
碘含量(以I计)
20~50 mg·kg-1
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用_________,恰好完全反应时的现象是_______________。
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________(填“偏高”、“偏低”或“没有影响”)。
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)________mg·kg-1(计算结果保留整数即可)。
高二化学综合题中等难度题查看答案及解析
-
结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。室温下,两支试管分别编号①和②,实验数据如下:
实验序号
①
②
③
加入试剂
4 mL 0.01mol/L酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
4 mL 0.01mol/L酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
一粒黄豆粒大的MnSO4固体
4 mL 0.01mol/L酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
一粒黄豆粒大的Na2SO4固体
褪色时间/s
116
6
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)草酸与酸性高锰酸钾的反应的离子方程式为:__________________________________
(2)实验①②结论是___________________________________________________________。
(3)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________。
(4)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为________。
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级
一级
配料
食盐、碘酸钾(KIO3)、抗结剂
碘含量(以I计)
20~50 mg·kg-1
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(5)c中加入的指示剂可选用_________,恰好完全反应时的现象是_______________。
(6))若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________(填“偏高”、“偏低”或“没有影响”)。
(7)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)_____mg·kg-1(计算结果保留整数即可)。
高二化学实验题中等难度题查看答案及解析
-
某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,实验数据如下:
实验序号
①
②
③
加入试剂
0.01mol/L KMnO4
0.1mol/L H2C2O4
0.01mol/L KMnO4
0.1mol/L H2C2O4
MnSO4固体
0.01mol/L KMnO4
0.1mol/L H2C2O4
Na2SO4固体
褪色时间/s
116
6
117
请回答:
(1)该实验结论是________。
(2)还可以控制变量,研究哪些因素对该反应速率的影响________。
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论。请你写出实验①的现象并分析产生该现象的原因________。
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是_________。
高二化学实验题中等难度题查看答案及解析
-
某同学进行影响草酸溶液与高锰酸钾酸性溶液反应速率因素的研究。室温下,实验数据如下:
实验序号
①
②
③
加入试剂
4mL 0.01mol/L KMnO4
2mL 0.1mol/L H2C2O4
4mL 0.01mol/L KMnO4
2mL 0.1mol/L H2C2O4
少量MnSO4固体
4mL 0.01mol/L KMnO4
2mL 0.1mol/L H2C2O4
少量Na2SO4固体
褪色时间/s
116
6
117
(1)草酸溶液与高锰酸钾酸性溶液反应的离子方程式为___________________。
(2)该实验结论是_______________________。
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论。请写出实验①的现象为____________________。
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是_________________。
(5)该同学拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。
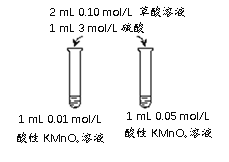
a.该同学拟研究的影响因素是___________________。
b.你认为该同学的实验方案_______________(填“合理”或“不合理”),理由是____________________________。
高二化学实验题困难题查看答案及解析
-
草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+-Mn2++CO2↑+H2O(未配平)
Ⅰ.甲同学研究外界因素对反应速率影响,设计如下实验方案:
用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别
10%硫酸体积/mL
温度/℃
其他物质
A
2mL
20
B
2mL
20
10滴饱和MnSO4溶液
C
2mL
30
D
1mL
20
V1 mL蒸馏水
E
0.5mL
20
V2 mL蒸馏水
(1)完成上述实验方案设计,其中:V1= ______ ,V2= ______ ;
(2)如果研究温度对化学反应速率的影响,使用实验 ______ 和 ______ .
(3)甲同学在做A组实验时,发现反应开始时速率较慢,随后加快.他分析认为高锰酸钾与 草酸溶液的反应放热,导致溶液温度升高,反应速率加快;从影响化学反应速率的因素看,你猜想还可能是 ______ ;
Ⅱ.乙同学利用如图测定反应速率
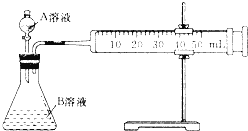
回答下列问题
(4)实验时要检查装置的气密性,简述操作的方法是 ______ ;
(5)乙同学通过生成相同体积的CO2来表示反应的速率,需要 ______ 仪来记录数据.
高二化学简答题中等难度题查看答案及解析
-
草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+-Mn2++CO2↑+H2O(未配平)
Ⅰ.甲同学研究外界因素对反应速率影响,设计如下实验方案:
用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别
10%硫酸体积/mL
温度/℃
其他物质
A
2mL
20
B
2mL
20
10滴饱和MnSO4溶液
C
2mL
30
D
1mL
20
V1 mL蒸馏水
E
0.5mL
20
V2 mL蒸馏水
(1)完成上述实验方案设计,其中:V1= ______ ,V2= ______ ;
(2)如果研究温度对化学反应速率的影响,使用实验 ______ 和 ______ .
(3)甲同学在做A组实验时,发现反应开始时速率较慢,随后加快.他分析认为高锰酸钾与 草酸溶液的反应放热,导致溶液温度升高,反应速率加快;从影响化学反应速率的因素看,你猜想还可能是 ______ ;
Ⅱ.乙同学利用如图测定反应速率
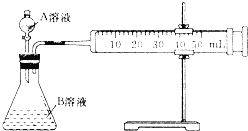
回答下列问题
(4)实验时要检查装置的气密性,简述操作的方法是 ______ ;
(5)乙同学通过生成相同体积的CO2来表示反应的速率,需要 ______ 仪来记录数据.
高二化学综合题中等难度题查看答案及解析
-
某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:
实验编号
实验温度
试管中所加试剂及其用量 / mL
溶液褪至无色所需时间/ min
0.6mol/L H2C2O4
溶液
H2O
3mol/L H2SO4
稀溶液
0.05mol/L
KMnO4溶液
①
25
3.0
V1
2.0
3.0
1.5
②
25
2.0
3.0
2.0
3.0
2.7
③
50
2.0
V2
2.0
3.0
1.0
(1)请写出该反应的离子方程式__________________________________________,当该反应以表中数据反应完全时转移电子数为_______________NA
(2)V1 ______
(3)根据上表中的实验①、②数据,可以得到的结论是_____。
(4)探究温度对化学反应速率的影响,应选择_____(填实验编号)
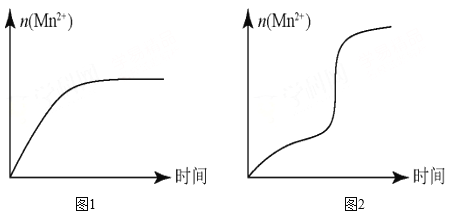
(5)该小组同学根据经验绘制了 n (Mn 2+ )随时间变化的趋势如图 1 所示,但有同学查阅已有的实验资料发现,该实验过程中 n (Mn 2+ ) 随时间变化的实际趋势如图 2 所示。
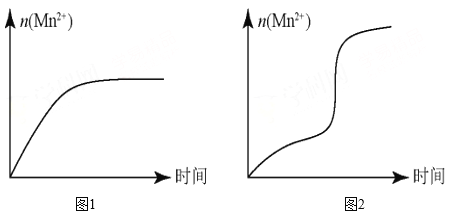
该小组同学根据图 2 所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号
实验温度/℃
试管中所加试剂及其用量
再加入某种固体
溶液褪至无色所需时间 / min
④
25
0.6mol/L H2C2O4 溶液
H2O
3mol/L H2SO4 稀溶液
0.05mol/L KMnO4 溶液
2.0
3.0
2.0
3.0
MnSO4
t
①该小组同学提出的假设是_____。
②若该小组同学提出的假设成立,应观察到_________________________________现象。
高二化学实验题中等难度题查看答案及解析
-
某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:
实验编号
实验温度
试管中所加试剂及其用量 / mL
溶液褪至无色所需时间/ min
0.6mol/L H2C2O4
溶液
H2O
3mol/L H2SO4
稀溶液
0.05mol/L
KMnO4溶液
①
25
3.0
V1
2.0
3.0
1.5
②
25
2.0
3.0
2.0
3.0
2.7
③
50
2.0
V2
2.0
3.0
1.0
(1)请写出该反应的离子方程式__________________________________________,当该反应以表中数据反应完全时转移电子数为_______________NA
(2)V1 ______
(3)根据上表中的实验①、②数据,可以得到的结论是_____。
(4)探究温度对化学反应速率的影响,应选择_____(填实验编号)
(5)该小组同学根据经验绘制了 n (Mn 2+ )随时间变化的趋势如图 1 所示,但有同学查阅已有的实验资料发现,该实验过程中 n (Mn 2+ ) 随时间变化的实际趋势如图 2 所示。
该小组同学根据图 2 所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号
实验温度/℃
试管中所加试剂及其用量
再加入某种固体
溶液褪至无色所需时间 / min
④
25
0.6mol/L H2C2O4 溶液
H2O
3mol/L H2SO4 稀溶液
0.05mol/L KMnO4 溶液
2.0
3.0
2.0
3.0
MnSO4
t
①该小组同学提出的假设是_____。
②若该小组同学提出的假设成立,应观察到_________________________________现象。
高二化学实验题中等难度题查看答案及解析