-
下列说法正确的是
A. 常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大
B. 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C. 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
D. 物质的溶解度都随温度的升高而增加,物质的溶解都是吸热的
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A. NaHS溶于水: NaHS
H++S2-+ Na+
B. NaHCO3溶液中的水解平衡:HCO3-+H2O
H3O++ CO32-
C. (NH4)2SO4溶于水:(NH4)2SO4
2NH4++SO42-
D. HF溶于水:HF+H2O
H3O++F-
难度: 中等查看答案及解析
-
下列说法不正确的是
A. NH4F水溶液存放于塑料试剂瓶中
B. 明矾可以用来净水,是利用明矾水解生成Al(OH)3胶体,从而起到杀菌消毒功效
C. 将 Fe2(SO4)3的溶液蒸干、灼烧可得到Fe2(SO4)3固体
D. 草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效
难度: 中等查看答案及解析
-
醋酸溶液中存在电离平衡:CH3COOH
H++CH3COO-,下列叙述不正确的是
A. 0.1 mol/L 的CH3COOH 溶液加水稀释或加热均可使CH3COO-的物质的量增多
B. 0.1 mol/L 的CH3COOH 溶液加水稀释,c(CH3COO-)/[c(CH3COOH) ·c(OH-)]不变
C. 向0.1 mol/L CH3COOH溶液中加入少量纯醋酸,平衡向右移动,电离程度增大
D. 0.1 mol/L CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(CH3COO-)的值减小
难度: 中等查看答案及解析
-
关于化学反应速率和限度,下列说法正确的是:
A. 密闭容器中进行的如下反应:2X(g)+Y(g)
Z(g)+W(s) ΔH>0,升高温度,正反应速率增大,逆反应速率减小
B. 对于反应:H2S(g)
H2(g)+S(s) ΔH>0 ,加压或降温都能使化学平衡向逆反应方向移动
C. 一定条件下,2L 密闭容器中存在反应:CO(g)+H2O(g)
CO2(g)+H2(g) △H<0。达平衡后再充入一定量的CO(g),平衡正向移动,平衡常数K变大
D. 增大反应物的浓度,平衡向右移动,生成物的百分含量不一定增大
难度: 中等查看答案及解析
-
下列指定溶液中一定能大量共存的离子组是
A. 含有大量AlO
的溶液中:Na+、K+、HCO3-、NO3-
B. pH=1的溶液中:NH4+、Na+、Fe3+、SO42-
C. 水电离产生c(H+)=1×10-13 mol/L溶液中:K+、Al3+、Cl-、SO42-
D. Na2S溶液中:SO42-、K+、Cu2+、Cl-
难度: 困难查看答案及解析
-
某学生的实验报告中,描述合理的是
A. 用托盘天平称量25.20g NaCl
B. 用pH试纸测得NaClO溶液的pH约为11
C. 用25mL碱式滴定管量取出15.00mLKMnO4溶液
D. 将CuSO4溶液蒸发浓缩、降温结晶、过滤得到硫酸铜晶体
难度: 中等查看答案及解析
-
下列说法正确的是
A. 向氨水中加水稀释后,溶液中除了H2O以外其他粒子浓度都下降
B. 若NaHC2O4溶液的pH=5,则溶液中c(C2O42-)<c(H2C2O4)
C. pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原溶液体积的m倍和n倍,若稀释后两溶液的pH仍相同,则m<n
D. pH=4的氯化铵溶液与pH=4的稀盐酸中,由水电离出的c(H+)之比为106∶1
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体
HX放出的氢气多且产生等量H2反应速率快
酸的强弱:HX<HY
B
向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4
先生成白色沉淀,后生成黑色沉淀
溶度积(Ksp):ZnS>CuS
C
向FeCl3和KSCN混合溶液中,加入少量KCl的固体
溶液颜色变浅
FeCl3+3KSCN
Fe(SCN)3 +3KCl平衡向逆反应方向移动
D
常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH
pH:NaA>NaB
常温下酸性:HA﹤HB
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)
bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是

A. 根据上图可求得方程式中a∶b=1:3
B. 推测在第7min时曲线变化的原因可能是升温
C. 推测在第13min时曲线变化的原因可能是降温
D. 用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min)
难度: 困难查看答案及解析
-
己知NA为阿伏加德罗常数的数值,下列说法正确的是
A. 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
B. 一定条件下在密闭容器中2 molSO2与2 molO2充分反应,最终的气体分子数为3NA
C. 将lmolNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
D. 将含0.1molFeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为0.1NA
难度: 困难查看答案及解析
-
常温下,将pH=12的Ba(OH)2 与pH=9的NaOH溶液等体积混合后溶液中的氢离子浓度(mol •L-1)为
A. 5×10-10 B. 2×10-12 C. 5×10-12 D. (10-12 +10-9)/2
难度: 困难查看答案及解析
-
下列有关说法正确的是
A. 已知HI(g)
1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为ΔH=-285.8 kJ·mol-1
C. 已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D. 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
难度: 困难查看答案及解析
-
将等体积的0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液混合得到浊液,过滤后进行如下实验:
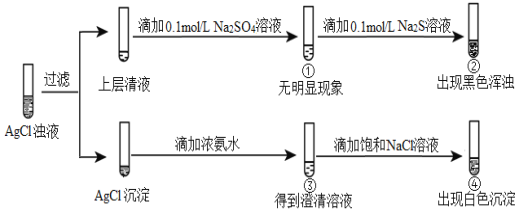
下列分析不正确的是
A. ①的现象说明上层清液中不含Ag+
B. ②的现象说明该温度下Ag2S比Ag2SO4更难溶
C. ③中生成Ag(NH3)2+,促进AgCl(s)溶解平衡正向移动
D. 若向③中滴加一定量的硝酸,也可以出现白色沉淀
难度: 困难查看答案及解析
-
下列说法正确的是
A. 常温下,向0.1mol/L CH3COONa溶液中通入HCl至溶液pH=7: c(Na+)>c(CH3COOH) =c(Cl-)
B. 常温时,将pH=1的醋酸和pH=13的NaOH溶液等体积混合后的溶液: c(Na+)>c(CH3COO-)>c(OH-) >c(H+)
C. 常温下0.1 mol·L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
D. 常温下,0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合后 c(CH3COO-)+c(CH3COOH)-c(Na+)=0.1 mol·L-1
难度: 困难查看答案及解析
-
25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
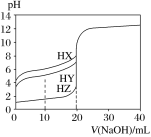
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B. 根据滴定曲线可得Ka(HX)的数量级是10-7
C. 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D. HY与HZ混合,达到平衡时c(H+)=Ka(HY).c(HY)/c(Y-)+c(Z-)+c(OH-)
难度: 困难查看答案及解析
-
在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)
3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是

A. 反应物A的浓度:a点小于b点
B. A的平均反应速率:ab段大于bc段
C. 曲线上的c、d两点都表示达到平衡状态
D. 该反应的生成物可能对反应起催化作用
难度: 困难查看答案及解析
-
室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是
加入物质
结论
A
50 mL 1 mol·L-1H2SO4
反应结束后,c(Na+)=c(SO42-)
B
0.05 mol CaO
溶液中c(OH-)c(HCO3-)增大
C
50 mL H2O
由水电离出的c(H+)·c(OH-)不变
D
0.1 mol NaHSO4固体
反应完全后,溶液pH减小,c(Na+)不变
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g)
3Z(g)△H<0反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。

下列推断正确的是
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
难度: 中等查看答案及解析
-
溶液的酸碱性可用酸度(AG)表示[AG=lg c(H+)/c(OH−) ]。室温下,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示,下列叙述正确的是
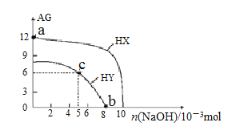
A. HX、HY均为弱酸
B. a点由水电离出的c(H+)=1.0×10-12mol·L-1
C. c点溶液中:c(HY) <c(Na+)<c(Y-)
D. b点时,溶液的pH=7,酸碱恰好完全中和
难度: 困难查看答案及解析
-
下列是25 ℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式
AgCl
Ag2CrO4
CH3COOH
HClO
H2CO3
Ksp或Ka
Ksp=1.8×10-10
Ksp=9.0×10-12
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.1×10-7
Ka2=5.6×10-11
A. H2CO3、HCO3-、CH3COO-、ClO- 在溶液中可以大量共存
B. 等体积等浓度的CH3COONa和NaClO中离子总数:CH3COONa <NaClO
C. 向浓度均为1.0×10-3 mol·L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol·L-1的AgNO3溶液,CrO42―先形成沉淀
D. 向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5∶9,此时溶液的pH=5
难度: 困难查看答案及解析