-
中国文化源远流长,下列对描述内容所做的相关分析不正确的是
A
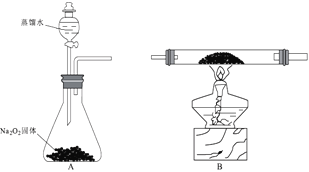
“以火烧之,紫青烟起,乃真硝石(KNO3)”
“紫青烟”是因为发生了焰色反应
B
“煤饼烧蛎成灰”
这种灰称为“蜃”,主要成分为Ca(OH)2
C
司南之杓(勺)投之于地,其柢(勺柄)指南”
司南中“杓”的材质为Fe3O4
D
“信州铅山县有苦泉,流以为涧。抱其水熬之,则成胆矾”
其中涉及到的操作有结晶
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 17gH2O2所含非极性键数目为0.5NA
B. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA
C. 100gCaS和CaSO4的混合物中含有32g硫,则含有的氧原子数为1.75NA
D. n(H2CO3)和n(HCO3)之和为1mol的 NaHCO3溶液中,含有Na+数目为NA
难度: 简单查看答案及解析
-
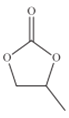
25℃时,将浓度均为0.1mo1·L-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=1000mL,Va、Vb与混合液的pH的关系如图所示。说法正确的是
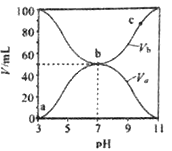
A. Ka(HA)=1×10-6
B. b点时,水电离出的c(H+)=10-7mo/L
C. a→c过程中水的电离程度始终增大
D. c点时,
随温度升高而减小
难度: 中等查看答案及解析
-
短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是
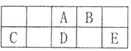
A. A有5种正价,与B可形成6种化合物
B. 工业上常通过电解熔融态C2B3的方法来获得C的单质
C. D和E两元素形成的化合物每种原子最外层都达到了8e稳定结构
D. 简单离子的半径由大到小为:E>A>B>C
难度: 中等查看答案及解析
-
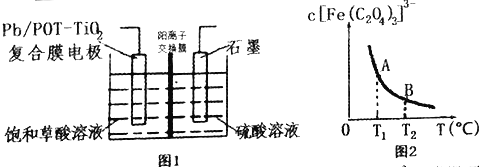
现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。下列说法不合理的是
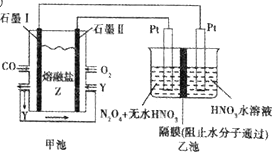
A. 若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.2mol
B. 石墨I是原电池的负极,发生氧化反应
C. 乙池中左端Pt极电极反应式:N2O4-2e-+2H2O===2N2O5+4H+
D. 甲池中的CO32-向石墨I极移动
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
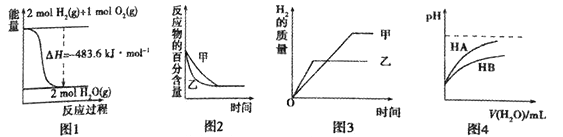
A. 图1表示H2与O2发生反应过程中的能量变化,则H的燃烧热为241.8kJ·mo1-1
B. 图2表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
C. 若图3表示等质量的钾、钠分别与足量水反应,则甲代表钠
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
难度: 中等查看答案及解析
-
下列各实验的叙述正确的是
选项
实验内容
实验目的或结论
A
将溴水、苯、FeBr3混合于烧瓶中
制备溴苯
B
某样品进行焰色反应时产生黄色火焰
该样品是钠盐
C
常温下,用精密pH试纸分别测定浓度均为0.1mol·L-1的NaClO溶液和 CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
D
以酚酞作指示剂,用一定浓度的NaOH溶液滴定一定体积、一定浓度的草酸溶液[已知K1(H2C2O4)=5.4×10-2、K2(H2C2O4)=6.4×10-5]
证明草酸是二元酸
A. A B. B C. C D. D
难度: 中等查看答案及解析