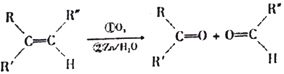
-
下列属于盐的是
A. Na2CO3 B. MgO C. NaOH D. CH4
难度: 简单查看答案及解析
-
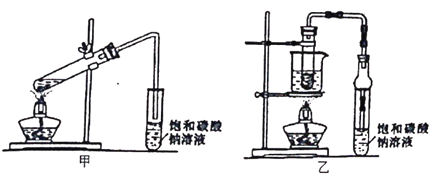
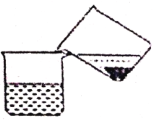
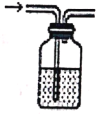
下列图示与操作名称不对应的是
A. 洗气
 B. 过滤
B. 过滤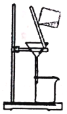
C. 加热蒸发
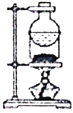 D. 分液
D. 分液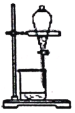
难度: 简单查看答案及解析
-
下列属于非电解质的是
A. 金属铜 B. 浓硫酸 C. 氨气 D. 水
难度: 简单查看答案及解析
-
下列物质的水溶液,滴入酚酞可能变红的是
A. CH3COONa B. NH4Cl C. NaCl D. NaHSO4
难度: 简单查看答案及解析
-
下列属于物理变化的是
A. 煤的气化 B. 石油裂化 C. 石油分馏 D. 橡胶老化
难度: 简单查看答案及解析
-
下列说法正确的是
A. 海水中提取镁的工业流程中,涉及到置换反应
B. 侯氏制碱工业是以氯化钠为主要原料,制得大量NaOH
C. 我国华为AI芯片已跻身于全球AI芯片榜单前列,该芯片的主要材料是二氧化硅
D. 垃圾分类是化废为宝的重要举措,厨余垃圾可用来制沼气或堆肥
难度: 中等查看答案及解析
-
下列变化过程,需要加入还原剂才能实现的是
A. Fe
Fe2+ B. SO2
S C. NH4+
NH3 D. KMnO4
O2
难度: 简单查看答案及解析
-
下列表示正确的是
A.
的电子式:
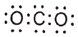 B. 乙醛的结构简式:
B. 乙醛的结构简式:C. 乙炔的比例模型:
 D. 氟离子的结构示意图:
D. 氟离子的结构示意图:
难度: 简单查看答案及解析
-
下列物质能与水反应产生氢气的是
A. 氯酸钾 B. 二氧化硅 C. 金属钠 D. 氯气
难度: 简单查看答案及解析
-
下列说法正确的是
A. 可用NaOH溶液鉴别碳酸钠和碳酸氢钠两种稀溶液
B. 可用分液的方法除去乙酸乙酯中的乙酸
C. 可用品红溶液鉴别三氧化硫和二氧化硫
D. 可用丁达尔现象区分淀粉溶液和氢氧化铁胶体
难度: 中等查看答案及解析
-
下列说法不正确的是
A. C6H14所有的同分异构体中主链为4个碳的只有2种
B. CH3CO18OCH2CH3在酸性条件下水解能得到CH3CH218OH
C.
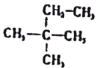 的名称是2-甲基-2-乙基丙烷
的名称是2-甲基-2-乙基丙烷D.
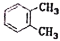 与
与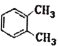 是同一种物质
是同一种物质难度: 中等查看答案及解析
-
X、Y、Z、M四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
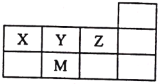
A. 原子半径:M>Z>Y>X
B. Z的气态氢化物最稳定,因其分子间存在氢键
C. 最高价氧化物对应水化物的酸性M<Z
D. 元素的非金属性:X<Y<Z
难度: 中等查看答案及解析
-
下列离子方程式不正确的是
A. 少量SO2气体通入次氯酸钠溶液中:SO2+3ClO-+H2O=SO42-+Cl-+2HClO
B. 氧化铁溶于HI溶液:Fe2O3+6H+=2Fe3++3H2O
C. 碳酸氢钠与过量Ba(OH)2溶液反应:HCO3-+OH-+Ba2+=BaCO3
+H2O
D. 向硅酸钠水溶液中通入过量CO2气体:SiO32-+2H2O+2CO2=2HCO3-+H2SiO3
难度: 中等查看答案及解析
-
一定温度下,在某体积固定的密闭容器中加入2 mol A和1 mol B,发生可逆反应2A(g)+ B(g)
3C(g) ΔH = - a kJ/mol,下列说法正确的是
A. 当容器内压强不变时说明反应已达到平衡
B. 当反应达到平衡时c(A):c(B):c(C) = 1:2:3
C. 当反应达到平衡时放出热量a kJ
D. 其他条件不变,升高温度反应速率加快
难度: 简单查看答案及解析
-
下列说法正确的是
A. 乙烷和乙烯都能用来制取氯乙烷,且反应类型相同
B. 无水乙醇比医用酒精的消毒效果更好
C. 除去甲烷的乙烯可通过酸性高锰酸钾溶液洗气
D. 甲苯和乙苯都是苯的同系物
难度: 简单查看答案及解析
-
下列说法正确的是
A. 油脂的水解和蛋白质的变性都是物理变化
B. 纤维素和淀粉的化学式相同,两者互为同分异构体
C. 羊毛和蚕丝的主要成分均为蛋白质,是天然高分子化合物
D. 甘氨酸和丙氨酸通过缩合反应最多可以得到三种二肽
难度: 中等查看答案及解析
-
2017年4月,中国科学院长春应用化学研究所研究员张新波课题组提出并论证了基于反应6Li+N2
2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是

A. b极为电池的负极
B. 电池放电时Li+移向a极
C. b极的电极方程式为N2+6Li++6e- = 2Li3N
D. 金属锂在放电过程中发生还原反应
难度: 简单查看答案及解析
-
现有室温下pH = 12的两种溶液:①氨水 ②氢氧化钠溶液,下列说法正确的是
A. 两溶液的物质的量浓度均为0.01mol/L
B. 两溶液中c(NH4+) =c(Na+)
C. 取等体积的两溶液分别与同浓度的盐酸恰好完全反应,消耗盐酸的体积①<②
D. 分别稀释到pH = 10,两溶液所加蒸馏水的体积:②>①
难度: 中等查看答案及解析
-
下列说法正确的是
A. 硫酸钠溶液的导电过程发生了化学变化
B. 由于SiO2的分子间作用力比CO2大,导致SiO2的熔点比CO2高
C. 氢与其它元素只能形成共价化合物
D. 强电解质都是离子化合物
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1 mol N2和3 mol H2置于密闭容器中充分反应,形成N-H键的数目为6 NA
B. 22.4 L D2中含有的中子数目为2 NA
C. 7.8 g Na2O2中含有的离子数为0.4 NA
D. 常温常压下,1 mol氯气与足量的NaOH溶液完全反应转移电子数为NA
难度: 中等查看答案及解析
-
由合成气制备二甲醚,涉及如下反应:
(i)2CH3OH(g)
C2H4(g)+2H2O(g) ΔH1
(ii)2CH3OH(g)
CH3OCH3(g)+H2O(g) ΔH2
能量变化如图所示:
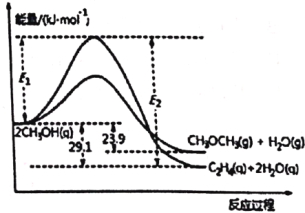
下列说法正确的是
A. ΔH1<ΔH2
B. 反应(ii)为吸热反应
C. C2H4(g)+H2O(g)
CH3OCH3(g) ΔH = -5.2 kJ·mol-1
D. 若在容器中加入催化剂,则E2-E1将变小
难度: 中等查看答案及解析
-
在一定温度下,10 mL 4.0 mol/L H2O2发生分【解析】
2H2O2H2O+ O2
,不同时刻测定生成O2的体积(已折算为标准状况)如下表:
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述正确的是(溶液体积变化忽略不计)
A. 6 min时反应速率υ(H2O2) = 3.33×10-2 mol/(L·mol)
B. 反应到6 min时,H2O2分解率为50%
C. 其他条件不变,若换用更高效的催化剂,达到平衡时将会得到更多氧气
D. 随时间增长得到的氧气更多,说明反应速率逐渐加快
难度: 中等查看答案及解析
-
常温下,将NaOH溶液滴加到某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示[已知:
]。下列叙述不正确的是

A. Ka(HA) = 10-4.76
B. 滴加NaOH溶液过程中,
保持不变
C. m点所示溶液中:c(H+) = c(HA)+c(OH-)-c(Na+)
D. n点所示溶液中可能:c((Na+) = c(A-)+c(HA)
难度: 中等查看答案及解析
-
已知矿石Cu5FeS4在空气中高温煅烧可得Fe2O3和CuO的固体混合物和一种能使酸性KMnO4溶液褪色的气体,下列说法正确的是
A. 该气体能使酸性KMnO4溶液褪色,体现了该气体具有漂白性
B. 所得气体使酸性KMnO4溶液褪色的离子方程式为:5SO2+2MnO4-+2H2O = 5SO42-+2Mn2++4H+
C. 将所得气体通入硝酸酸化的BaCl2溶液能产生不溶于硝酸的白色沉淀,说明所得气体中一定含有SO3
D. 将所得固体溶于稀硫酸,再向溶液中加入一定量铁粉,一定会有红色的铜析出
难度: 中等查看答案及解析
-
下列化学实验事实及其解释或结论都正确的是
A. 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
B. 向1 mL 1%的NaOH溶液中加入2 mL 2 %的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基
C. 向CuSO4溶液中加入KI溶液,有白色沉淀生成;再加入四氯化碳振荡,四氯化碳层呈紫色,白色沉淀可能为CuI
D. 某待测溶液可能含有等浓度的下列离子中的若干种K+、 Na+、 NH4+、 Mg2+、 Fe2+、Fe3+ 、 I-、CO32-、SO42-。现取少量待测溶液于试管,加入足量NaOH溶液得到白色沉淀,加热产生无色气体,则原溶液中是否含有K+、Na+,需通过焰色反应确定。
难度: 中等查看答案及解析

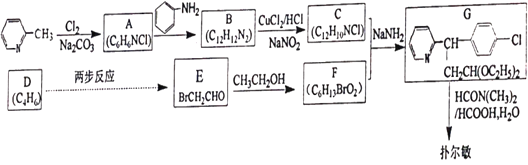
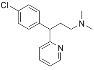 )是一种常见的抗过敏药物,其合成路线如下:
)是一种常见的抗过敏药物,其合成路线如下: