-
学校食堂提供了下列5种食物:①青菜②面包③米饭④猪肉⑤牛肉,小明为自己安排的午餐食谱中,从营养均衡角度考虑较合理的是( )
A. ① ③ ⑤ B. ① ② ③ C. ② ③ ④ D. ③ ④ ⑤
难度: 中等查看答案及解析
-
下列物品主要由有机合成材料制成的是( )
A.
 塑料保鲜盒 B.
塑料保鲜盒 B.  蚕丝围巾
蚕丝围巾C.
 大理石地砖 D.
大理石地砖 D.  陶瓷花盆
陶瓷花盆难度: 简单查看答案及解析
-
下列实验操作正确的是
A.
 点燃酒精灯 B.
点燃酒精灯 B.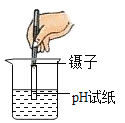 测溶液pH
测溶液pHC.
 闻气味 D.
闻气味 D. 倾倒液体
倾倒液体难度: 简单查看答案及解析
-
下列说法错误的是( )
A. 元素的种类是有限的,但有限的元素可以组成多种多样的物质
B. 通过化学反应可以合成自然界中不存在的物质
C. 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
D. 矿物能源在燃烧过程中遵循质量守恒定律,所以不存在能源危机
难度: 简单查看答案及解析
-
“书香”含有糖醛(C5H4O2),测定糖醛的含量可以检测书籍年代。下列说法错误的是( )
A.糖醛在氧气中完全燃烧生成CO2和H2O B.糖醛中碳、氢元素的质量比为12:1
C.糖醛的相对分子质量为96 D.糖醛中碳元素的质量分数为62.5%
难度: 中等查看答案及解析
-
为完成以下实验内容,涉及的实验操作合理的是( )
选项
实验内容
实验操作
A
稀释浓硫酸
先往烧杯中倒浓硫酸,后加蒸馏水
B
用KMnO4制氧气
先熄灭酒精灯,后从水中移出导管
C
除去H2中的HCl杂质
先通过浓硫酸,后通过饱和NaHCO3溶液
D
用CO还原Fe2O3
先通CO一段时间,后加热Fe2O3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
t1℃时,取a、b两种固体物质各25g于两只烧杯中,分别加入100g水,充分溶解后,两种固体均有剩余。升温到t2℃时,a完全溶解,b固体增多。a、b两种物质的溶解度曲线如图所示。以下判断正确的是( )

A. 图中曲线M表示b物质的溶解度曲线
B. t1℃时,两只烧杯中剩余物质的质量不相等
C. t2℃时,两只烧杯中的溶液都是饱和溶液
D. t2℃时,两只烧杯中溶液的溶质质量分数相同
难度: 困难查看答案及解析
-
我国科学家合成的新型催化剂,可将CO2高效转化为甲醇(CH3OH)。该反应的微观变化示意图如下。下列说法正确的是( )
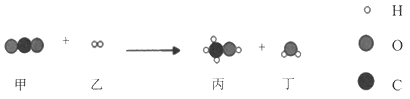
A. 该反应中四种物质均为化合物 B. 反应前后氢元素的化合价不变
C. 反应前后原子数目发生改变 D. 参加反应的甲、乙分子个数比为1:3
难度: 中等查看答案及解析
-
一定条件下,一个密闭容器内发生反应,测得反应前后各物质的质量如下表所示.下列有关说法不正确的是( )
物质
A
B
C
D
反应前的质量(g)
15
15
25
20
反应后的质量(g)
0
10
x
y
A.x的取值范围是:0≤X≤45 B.参加反应的A和B的质量之比为3:1
C.当y≤20时,该反应为化合反应 D.x+y=65
难度: 困难查看答案及解析
-
下列图像能正确反映对应变化关系的是( )
A.
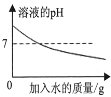 常温下,稀释KOH溶液
常温下,稀释KOH溶液B.
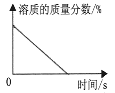 将浓硫酸露置在空气中
将浓硫酸露置在空气中C.
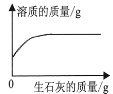 一定质量的饱和石灰水中加入生石灰
一定质量的饱和石灰水中加入生石灰D.
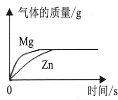 足量粉末状金属分别与等质量、等浓度的稀盐酸反应
足量粉末状金属分别与等质量、等浓度的稀盐酸反应难度: 中等查看答案及解析