-
下列化学药品名称与警示性标签对应不正确的是
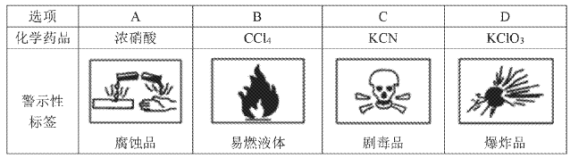
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法中错误的是
A. 用高锰酸钾溶液、酒精、双氧水杀菌消毒原理相同
B. 国产大飞机-C919使用的碳纤维是一种新型的无机非金属材料
C. 丝绸的主要成分是蛋白质,属于天然高分子化合物
D. “青蒿一握,以水二升渍,绞取汁”,该过程属于物理变化
难度: 中等查看答案及解析
-
以下说法正确的是
A. 苯与溴水在催化剂作用下发生取代反应
B. 可用NaOH溶液除去乙酸乙酯中的乙酸
C. 交警用红色CrO3检查酒驾,利用了乙醇的还原性
D. 酯类、糖类、油脂和蛋白质一定条件下都能发生水解反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 0.5mol
含中子数为8NA
B. 常温下,1 mol NH4Cl含共价键数目为5NA
C. 足量的Cu与含溶质1mol的浓H2SO4反应,转移的电子数为NA
D. 标况下,22.4LNO和11.2LO2混合后的气体分子数为NA
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是
A. 用氨水吸收少量SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B. 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C. FeO和稀HNO3的反应:FeO+2H+=Fe2++H2O
D. 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑
难度: 中等查看答案及解析
-
A和B转化为C的催化反应历程示意图如下。下列说法不正确的是
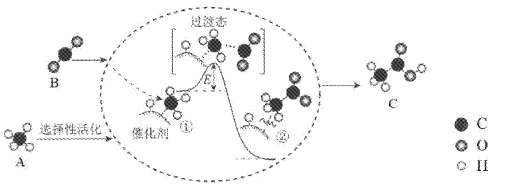
A. 催化剂在反应前后保持化学性质不变
B. 生成C总反应的原子利用率为100%
C. ①→②的过程吸收能量
D. C的水溶液呈弱酸性
难度: 中等查看答案及解析
-
下列有关化学原理在工业上的应用,说法正确的是
A. 合成NH3时高温是为了提高转化率
B. 甲烷、乙烯和苯都可通过石油分馏得到
C. 电解饱和氯化镁溶液可以制取金属镁
D. 可通过反应C+H2O
CO+H2制水煤气
难度: 简单查看答案及解析
-
铅(Pb)的原子序数为82,有+2、+4两种常见化合价。PbO2随温度的升高发生如下变化:PbO2→Pb2O3→Pb3O4→PbO。下列说法不正确的是
A. Pb位于周期表ⅣA族
B. Pb3O4可以写成2PbO·PbO2
C. PbO2分解生成Pb2O3同时生成O2
D. PbO2可作为铅蓄电池的正极,放电时发生氧化反应
难度: 中等查看答案及解析
-
向下列溶液中通入足量相应气体后,各离子组还能大量存在的是
A. 二氧化碳:K+、Na+、CO32-、Cl- B. 氨气:Mg2+、Al3+、Na+、NO3-
C. 氯化氢:Ca2+、Fe3+、NO3-、Cl- D. 氯气:Na+、Ba2+、HCO3-、HSO3-
难度: 中等查看答案及解析
-
下列物质能实现“
 ”转化关系的是
”转化关系的是A. Al B. FeO C. NaHCO3 D. NH3
难度: 中等查看答案及解析
-
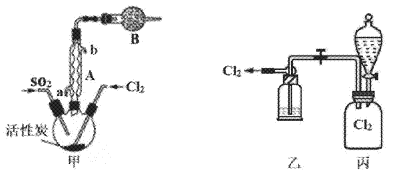
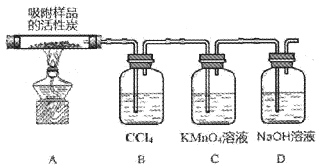
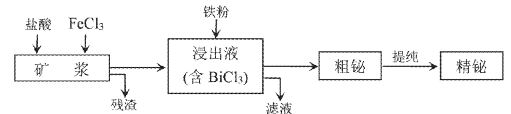
下列实验操作正确且能达到相应实验目的的是
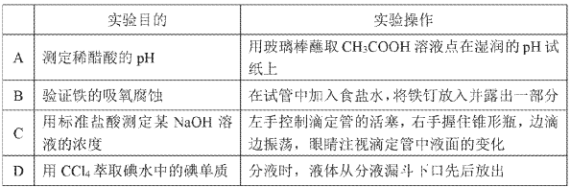
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
有机物M在模拟酶用于可视化生物硫醇检验中起到重要的作用,结构简式如下图。有关M的说法不正确的是
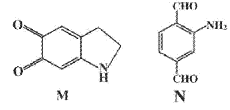
A. 分子式为C8H7NO2
B. 可发生取代反应、加成反应、氧化反应
C. 分子中所有碳原子都在同一平面上
D. 有机物N是M的同分异构体
难度: 简单查看答案及解析
-
工业上由黄铜矿(主要成分为 CuFeS2)冶炼铜的主要流程如下。下列说法不正确的是

A. 气体A中的大气污染物可用氨水吸收并回收利用
B. 由泡铜冶炼粗铜的化学方程式为3Cu2O+2Al
Al2O3+6Cu
C. 加入石英砂作为添加剂熔剂,生成更稳定、更容易分离的硅酸盐
D. 用过量稀H2SO4可全部溶解熔渣B
难度: 中等查看答案及解析
-
最近我国成功研制出高效电催化固氮催化剂Mo2N,如图所示,在0.1mol·L-1盐酸溶液中,在一定电压下具有较高的产氨速率和稳定的电流效率。下列判断错误的是
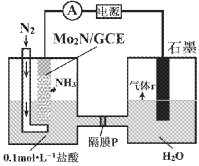
A. 石墨电极为阳极
B. P为阳离子交换膜
C. Mo2N/GCE电极区反应式为N2+6H++6e-=2NH3
D. 为提高溶液的导电性,可在石墨电极区加入适量的盐酸
难度: 中等查看答案及解析
-
短周期主族元素W、Ⅹ、Y、Z原子序数依次增大,W和X可形成一种易与血红蛋白相结合而使人中毒的化合物,Y和Z同周期且最外层电子数之和为8。下列说法不正确的是
A. X和Y形成的物质对应的水化物一定为强碱
B. 原子半径大小:Y>Z>W>X
C. X和Z可以形成一种杀菌消毒剂
D. W和Z形成的是共价化合物
难度: 中等查看答案及解析
-
氮化镁常用于制备其它超硬、高导热、耐高温的氮化物,实验室用以下装置制取氮化镁。已知:Mg+2NH3
Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。下列说法不正确的是
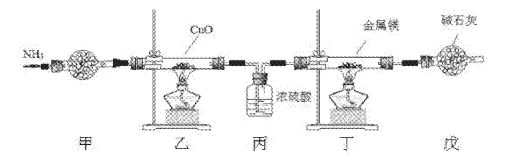
A. 实验开始时应先点燃乙处酒精灯,再点燃丁处酒精灯
B. 装置乙的目的是制备N2
C. 装置丙与装置戊可以对调
D. 取装置丁所得固体少许,滴入少量蒸馏水,可检验是否有Mg3N2
难度: 中等查看答案及解析
-
柠檬酸(用H3R表示)可用作酸洗剂。常温下,向0.1mol·L−1 H3R溶液中加入少量的NaOH固体(忽略溶液体积的变化),H3R、H2R−、HR2−和R3−的含量与pH的关系如图所示。下列正确的是
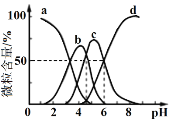
A. 图中b曲线表示HR2−的变化
B. HR2−的电离常数Ka3=10−6
C. pH=7时,c(Na+)=c(H2R−)+c(HR2−)+c(R3−)
D. pH=5时,c(H2R−)+c(HR2−)+c(R3−)=0.1mol·L−1
难度: 中等查看答案及解析
-
已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mo1·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是
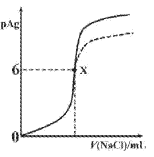
A. 原AgNO3溶液的物质的量浓度为0.1mol·L-1
B. 图中x点表示溶液中Ag+恰好完全沉淀
C. 图中x点的坐标为(10,6)
D. 若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分
难度: 简单查看答案及解析