-
以下食品中的有机成分属于高分子化合物的是( )
A. 谷类中含有的淀粉 B. 植物油、动物脂肪中含有的油脂
C. 食醋中含有的醋酸 D. 酒中含有的酒精
难度: 简单查看答案及解析
-
下列物质中属于盐的是
A. MgO B. H2SO4 C. NaOH D. KNO3
难度: 简单查看答案及解析
-
下列物质的变化,不能通过一步化学反应完成的是
A. Cu→CuSO4 B. SiO2→H2SiO3 C. Cl2→HClO D. NO2→HNO3
难度: 中等查看答案及解析
-
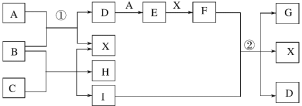
常温下,下列各组物质中,Y 既能与 X 反应又能与 Z 反应的是
X
Y
Z
①
NaOH 溶液
KAlO2
稀硫酸
②
KOH 溶液
NaHCO3
浓盐酸
③
O2
N2
H2
④
FeCl3溶液
Cu
浓硝酸
A. ①③ B. ①④ C. ②④ D. ②③
难度: 中等查看答案及解析
-
短周期主族元素W、R、X、Y、Z的原子序数依次增大,W的原子半径是周期表中所有元素中最小的,R是地壳中含量最多的元素,X与W同主族,Y的最外层电子数是最内层电子数的3倍。下列说法正确的是( )
A. 原子半径:R<Y<Z
B. 简单气态氢化物的热稳定性:R>Y
C. R与Y只能形成一种化合物
D. 最高价氧化物对应水化物的酸性:Y>Z
难度: 中等查看答案及解析
-
我国宣布到2030年非化石能源占一次能源消费比重将提高到20%左右.下列不属于化石能源的是
A. 煤 B. 石油 C. 天然气 D. 生物质能
难度: 简单查看答案及解析
-
下列关于16O和18O说法正确的是( )
A. 两者互为同位素 B. 两者互为同素异形体
C. 两者属于同一种核素 D. 两者属于不同的元素
难度: 简单查看答案及解析
-
下列物质中既含有共价键又含有离子键的是( )
A.C2H6 B.HNO3 C.Na2O D.KOH
难度: 中等查看答案及解析
-
下列物质或指定物质主要成分与化学式对应正确的是
A. 明矾—— Al2(SO4)3·12H2O B. 漂白粉——NaClO
C. 纯碱——NaHCO3 D. 水煤气——CO、H2
难度: 简单查看答案及解析
-
某溶液中大量存在Ba2+、H+、Cl-,该溶液中还可能大量存在的离子是
A. Ag+ B. SO42- C. CH3COO- D. Mg2+
难度: 中等查看答案及解析
-
下列化学用语表示正确的是( )
A. KF的电子式:
B. 异丁烷的结构简式:CH3CH2CH2CH3
C. 硫离子的结构示意图:
D. 氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH-)2
难度: 中等查看答案及解析
-
下列关于乙酸与乙醇的说法正确的是( )
A. 互为同分异构体 B. 都能氧化为乙醛
C. 水溶液均显酸性 D. 可用石蕊溶液进行鉴别
难度: 简单查看答案及解析
-
反应A+B=C+D的能量变化如图所示,下列说法正确的是
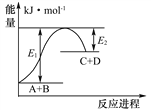
A. 该反应为放热反应
B. 该反应吸收的能量为(E1-E2)
C. 反应物A的能量低于生成物C的能量
D. 该反应只有在加热条件下才能进行
难度: 简单查看答案及解析
-
反应4A(s)+3B(g)
2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.8 mol·L-1·s-1
B. 在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
C. 分别用B、C、D表示反应的速率,其比值是3∶2∶1
D. 在这2 min内用B和C表示的反应速率的值都是相同的
难度: 中等查看答案及解析
-
下列实验装置或操作正确的是
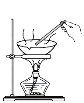
从碘水中
分离出碘
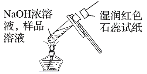
检验溶液中NH4+的存在
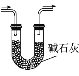
干燥SO2气体
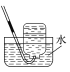
收集HCl气体
A
B
C
D
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有机反应属于取代反应的是( )
A. nCH2=CH2→
B. CH2=CH2+HCl → CH3CH2Cl
C. 2CH3CH2OH+O2
2CH3CHO+2H2O
D.
+Br2
+HBr
难度: 中等查看答案及解析
-
下列有关离子(或物质)的检验及结论正确的是( )
A. 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中含有K+
B. 向无色溶液中加入BaCl2溶液有白色沉淀出现,则溶液中含有SO42-
C. 用一束光照射氯化铁溶液和氢氧化铁胶体,都出现丁达尔现象
D. 向黄色溶液中加入淀粉,溶液变蓝色,则溶液中含有I2
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.
通入
溶液中 B.
通入
溶液中
C.
通入
溶液中 D.
通入已酸化的
溶液中
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.氯化铁溶液与碘化钾溶液反应:Fe3++2I-===Fe2++I2
B.硫酸溶液与氢氧化钡溶液反应:Ba2++SO42-===BaSO4↓
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D.氯化镁溶液与过量氨水反应:Mg2++2NH3·H2O===Mg (OH)2↓+2NH4+
难度: 中等查看答案及解析
-
右图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )
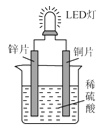
A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 其能量转化的形式主要是“化学能→电能→光能”
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
难度: 中等查看答案及解析
-
某水溶液中可能含有Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-离子中的若干种。某同学取200 mL该溶液分成两等份依次进行如下实验:①向第一份溶液中加过量的NaOH溶液后加热,充分反应后生成0.02 mol气体(标况),无沉淀产生,同时得到溶液甲;②向溶液甲中通入过量的CO2,充分反应生成白色沉淀,沉淀经过滤、洗涤、灼烧至恒重得到1.02 g固体;③向第二份溶液中加入足量的BaCl2溶液,充分反应生成白色沉淀,沉淀用盐酸充分洗涤、干燥,得到11.65 g固体。据此,该同学得到的结论正确的是( )
A. 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.02 mol/L
B. 实验③中的沉淀里一定有BaSO4,可能有Mg(OH)2
C. 若要确定原溶液中是否含有Cl-,无需另外再设计实验验证
D. 原溶液中一定含有Na+,且c(Na+)≥0.2 mol/L
难度: 困难查看答案及解析