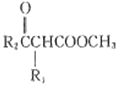-
2016年诺贝尔化学奖授予在合成分子机器领域做出贡献的三位科学家。分子机器是一种特殊的超分子体系,当体系受到外在刺激(如pH变化、吸收光子、电子得失等)时,分子组分间原有作用被破坏,各组分间发生类似于机械运动的某种热运动。下列说法不正确的是
A. 驱动分子机器时,需要对体系输入一定的能量
B. 分子状态的改变会伴随能量变化,属于化学变化
C. 氧化还原反应有可能是刺激分子机器体系的因素之一
D. 光照有可能使分子产生类似于机械运动的某种热运动
难度: 困难查看答案及解析
-
下列化学用语正确的是
A. 氯化钠的分子式:NaCl
B. NH4Br的电子式:
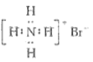
C. 比例模型
可以表示二氧化硫分子,也可以表示二氧化碳分子
D. Mg5(Si4O10)8(OH)2·4H2O的氧化物形式:5MgO·8SiO2·5H2O
难度: 中等查看答案及解析
-
轮烷的某种合成原料由C、H、O三种元亲组成,其球棍模型如图所示。

下列说法正确的是
A. 该化合物的名称为乙酸乙酯
B. 该化合物与Br2的四氯化碳溶液不反应
C. 该化合物能发生水解反应,不能发生加聚反应
D. 该化合物的链状同分异构体中,能与 NaHCO3反应放出CO2的只有3种(不考虑立体异构)
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
①31g白磷中含有1.5NA个P-P键
②1L0.1mol·L-1的Na2CO3溶液中所含阴离子的总数目为0.1NA
③标准状况下,22.4LHF中含有NA个分子
④电解精炼铜时,若转移NA个电子,则阳极溶解32g铜
⑤将2.24L(标准状况)Cl2溶于水,转移的电子数为0.1NA
⑥常温下,含有0.2molH2SO4的浓硫酸与足量铜反应,生成SO2分子的数目小于0.1NA
⑦142gNa2SO4和Na2HPO4的固体混合物中所含阴、阳离子的总数目为3NA
⑧NA个Fe(OH)3胶体粒子的质量为107g
A. ①③④ B. ①⑥⑦ C. ③⑤⑦ D. ①⑥⑧
难度: 困难查看答案及解析
-
科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是
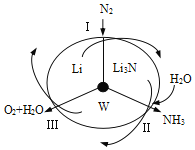
A. 过程I得到的Li3N中N元素为—3价
B. 过程Ⅱ生成W的反应为Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量的转化形式为化学能转化为电能
D. 过程Ⅲ涉及的反应为4OH--4e-=O2↑+2H2O
难度: 困难查看答案及解析
-
用多孔石墨电极完成下列实验。下列解释或推理合理的是
实验
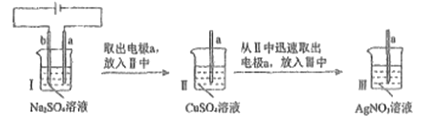
现象
I中,a.b两极均有气泡产生
II,a极上析出红色固体
III,a极上析出灰白色固体
A. Ⅰ中电解一段时间后,c(Na2SO4)一定增大
B. 由Ⅱ中反应H2+Cu2+=Cu↓+2H+可知,用玻璃导管将H2通入CuSO4溶液中,也会产生红色沉淀
C. Ⅲ中,只可能发生反应2Ag++Cu===Cu2++2Ag
D. I中,a极上既发生了化学变化,也发生了物理变化
难度: 困难查看答案及解析
-
常温下,向某浓度的H2C2O4溶液中逐滴加入已知浓度的NaOH溶液,若pC表示溶液中溶质微粒的物质的量浓度的负对数,则所得溶液中pC(H2C2O4),pC(HC2O4-)、pC(C2O42-)与溶液pH的变化关系如图所示。已知:H2C2O4
HC2O4-+H+ Ka1;HC2O4-
C2O42-+H+ Ka2。则下列说法正确的是
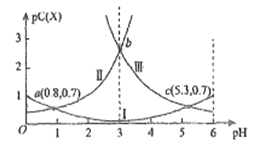
A. 当pH=3时,溶液中c(HC2O4-)<c(C2O42-)=c(H2C2O4)
B. pH由3增大到5.3的过程中,水的电离程度逐渐减小
C. 常温下,Ka2=10-5.3
D. 常下随着pH的增大:c2(HC2O4-)/[c(H2C2O4)c(C2O42-)] 的值先增大后减小
难度: 困难查看答案及解析
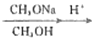 CH3OH+
CH3OH+