-
氢气是一种清洁能源。在冶金、电力、材料等领域应用广泛。请回答下列问题:
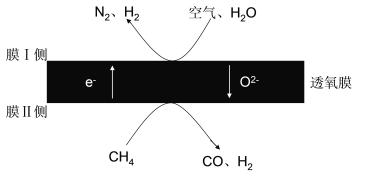
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图所示(空气中N2和O2的物质的量之比为4:1)。上述过程中,膜I侧所得气体的物质的量之比为n(H2):n(N2)=3:1,则氧化作用的物质为_______________,膜Ⅱ侧发生的电极反应式为_________________
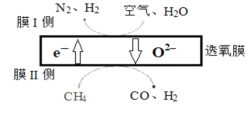
(2)用CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g) ⇌CH3OH(g) △H1
已知CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) △H2=-49.0kJ/mol
CO(g)+H2O(g) ⇌CO2(g)+H2(g) △H3=-41.1kJ/mol
则△H1=________________
(3)向体积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应:CO(g)+2H2(g) ⇌CH3OH(g),平衡时,CO的转化率α(CO)随温度、压强的变化情况如图1所示。
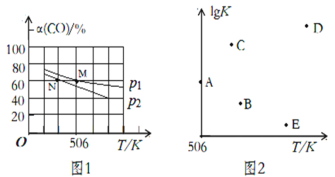
①压强p1_____(填“>”、“<”或“=”)p2;M点时,该反应的平衡常数Kp=______(用平衡分压表示,分压=总压×物质的量分数)
②不同温度下,该反应的平衡常数的对数值lgK如图2,其中A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是_____________
(4)H2还原NO的反应为2NO(g)+2H2(g)⇌N2(g)+2H2O(l),实验测得反应速率的表达式为v=k·cm(NO)·cn(H2)(k是速率常数,只与温度有关)。
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
| 编号 | c(H2)/(mol·L-1) | c(NO)/(mol·L-1) | v/(mol·L-1·min-1) |
| 1 | 0.10 | 0.10 | 0.414 |
| 2 | 0.10 | 0.20 | 1.656 |
| 3 | 0.50 | 0.10 | 2.070 |
由表中数据可知,m=_______,n=_______。
②上述反应分两步进行:ⅰ2NO(g)+2H2(g) ⇌N2(g)+H2O2(l)(慢反应)
ⅱH2O2(l)+H2(g) ⇌2H2O(l)(快反应)。下列说法正确的是_______
A. H2O2是该反应的催化剂 B. 总反应速率由反应ⅱ的速率决定
C. 反应ⅰ的活化能较高 D.反应ⅰ中NO和H2的碰撞仅部分有效
-
H2是一种清洁能源。在冶金、电力、材料等领域应用广泛。请回答下列问题:
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图甲所示(空气中N2与O2的物质的量之比按4:1计)。上述过程中,膜I侧所得气体的物质的量之比n(H2):n(N2)=3:1,则CH4、H2O与O2反应的化学方程式为______________________。
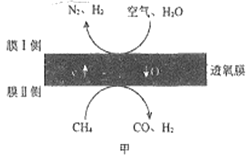
(2)用H2和CO合成甲醇的热化学方程式为CO(g)+2H2(g)  CH3OH (g) △H1。已知:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1;CO(g)+H2O(g)==CO2(g)+H2(g) △H3=-41.1k J·mol-1.则△H1=___________ k J·mol-1。
CH3OH (g) △H1。已知:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1;CO(g)+H2O(g)==CO2(g)+H2(g) △H3=-41.1k J·mol-1.则△H1=___________ k J·mol-1。
(3)向容积可变的密闭容器中充入1 mol CO和2.2molH2,在恒温恒压条件下发生反应CO(g)+2H2(g) CH3OH(g),平衡时,CO的转化率[α(CO)]随温度、压强的变化情况如图乙所示。
CH3OH(g),平衡时,CO的转化率[α(CO)]随温度、压强的变化情况如图乙所示。
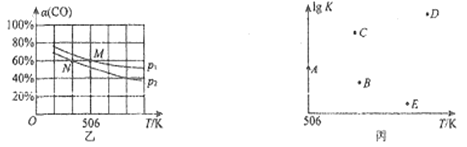
①压强:p1___________(填“>”<”或“=”)p2。
②M点时,H2的转化率为___________(计算结果精确到0.1%),该反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③不同温度下,该反应的平衡常数的对数值(lgK)如图丙所示,其中,A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是___________。
(4)H2还原NO的反应为2NO(g)+2H2(g) N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
| 编号 | c(H2)/(mol/L) | c(NO)/(mol/L) | v/(mol/Lmin) |
| 1 | 0.10 | 0.10 | 0.414k |
| 2 | 0.10 | 0.20 | 1.656k |
| 3 | 0.50 | 0.10 | 2.070k |
由表中数据可知,m=___________,n=___________。
②上述反应分两步进行:i.2NO(g)+H2(g)==N2(g)+H2O2(1)(慢反应);ii.H2O2(1)+H2(g)==2H2O(1)(快反应)。下列叙述正确的是___________(填字母)
A.H2O2是该反应的催化剂
B.反应i的活化能较高
C.总反应速率由反应ii的速率决定
D.反应i中NO和H2的碰撞仅部分有效
-
H2是一种重要的清洁能源。
(1)2018年我国某科研团队利用透氧膜,一步即获得合成氨原料和合成液态燃料的原料。其工作原理如图所示(空气中N2与O2的物质的量之比按4:1计)。工作过程中,膜I侧所得 =3,则膜I侧的电极方程式为________________________。
=3,则膜I侧的电极方程式为________________________。
(2)已知: CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0kJ/mol,
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3= -41.1 kJ/mol,H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g) CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
A.高温 B.低温 C.任何温度条件下
(3)恒温恒压下,在容积可变的密闭容器中加入1mol CO和2.2 mol H2,发生反应 CO(g)+2H2(g) CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
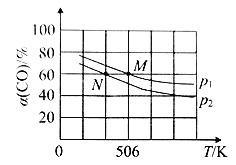
P1_______P2,判断的理由是____________________________。
(4)若反应CO(g)+2H2(g) CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
| 时间/min | 0 | 5 | 10 | 15 |
| H2 | 4 | | 2 | |
| CO | 2 | | | 1 |
| CH3OH(g) | 0 | 0.7 | | |
①下列各项能作为判断该反应达到平衡标志的是_____(填字母);
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=__________(kPa)-2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)= _______Pa/min。
-
H2是一种重要的清洁能源。
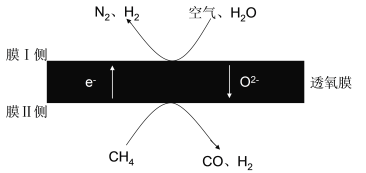
(1)2018年我国某科研团队利用透氧膜,一步即获得合成氨原料和合成液态燃料的原料。其工作原理如图所示(空气中N2与O2的物质的量之比按4:1计)。工作过程中,膜I侧所得 =3,则膜I侧的电极方程式为________________________。
=3,则膜I侧的电极方程式为________________________。
(2)已知: CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0kJ/mol,
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3= -41.1 kJ/mol,H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g) CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
CH3OH(g)ΔH1,则ΔH1=_____________ kJ/mol,该反应自发进行的条件为_________。
A.高温 B.低温 C.任何温度条件下
(3)恒温恒压下,在容积可变的密闭容器中加入1mol CO和2.2 mol H2,发生反应 CO(g)+2H2(g) CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
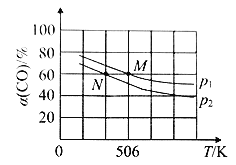
P1_______P2,判断的理由是____________________________。
(4)若反应CO(g)+2H2(g) CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化见下表所示:
| 时间/min | 0 | 5 | 10 | 15 |
| H2 | 4 | | 2 | |
| CO | 2 | | | 1 |
| CH3OH(g) | 0 | 0.7 | | |
①下列各项能作为判断该反应达到平衡标志的是_____(填字母);
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=__________(kPa)-2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)= _______Pa/min。
-
天津大学某科研团队创新地提出了一种基于电化学冶金原理并利用电解质去耦合策略,在电池中同时进行MnO2和Zn可逆溶解/电沉积的储能机制,其工作原理如图,电池放电总反应为Zn+4OH-+MnO2+4H+ Zn(OH)
Zn(OH) +Mn2++2H2O。下列说法不正确的是( )
+Mn2++2H2O。下列说法不正确的是( )
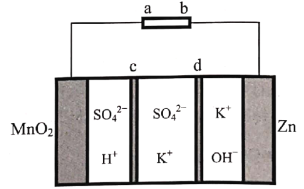
A.充电时,Zn电极区为阴极区
B.c为阴离子交换膜,d为阳离子交换膜
C.放电时,正极电极反应式为MnO2+4H++2e-=+Mn2++2H2O
D.充电时,电子的流向为a→MnO2→电解质溶液→Zn→b
-
H、N、Na、Al、Ti等元素在能源、材料等领域应用广泛。回答下列问题:
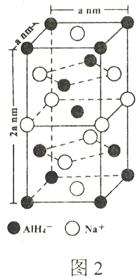
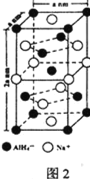
(一)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示,为长方体。
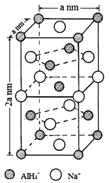
(1)基态Ti原子的价电子排布图为_________, L能层中电子云的形状有_______种。
(2)AlCl3在178℃时升华,属于__________晶体,其蒸气的相对分子质量约为267,蒸气分子的结构式为___________(标明配位键),其中 Al的轨道杂化方式为____________。
(3)写出与AlH4-空间构型相同的一种分子和一种离子_________(填化学式)。
(4)NaAlH4晶体中,与AlH4-紧邻且等距的Na+有__________个;NaAlH4晶体的密度为_____________g·cm-3(用含a的代数式表示)。
(二)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
(1)写出与N3-属于等电子体的一种分子__________(填分子式)。
(2)氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是___(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
-
目前铬被广泛应用于冶金、化工、铸铁及高精端科技等领域。回答下列问题:
(1)基态Cr原子价层电子的轨道表达式为_______,其核外有_______种不同能量的电子。
(2)Cr的第二电能离(ICr)和Mn的第二电离能(IMn)分别为1590.6 kJ·mol-1、1509.0 kJ·mol-1,ICr > IMn的原因是____________。
(3)过氧化铬CrO5中Cr的化合价为+6,则该分子中 键、
键、 键的数目之比为______。
键的数目之比为______。
(4)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___________。
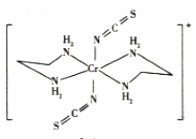
(5)Cr的一种配合物结构如图所示,该配合物中碳原子的杂化方式是_______,阳离子中Cr原子的配位数为_________,ClO 的立体构型为________。
的立体构型为________。
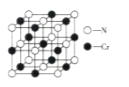
(6)氮化铬晶体的晶胞结构如图所示,Cr处在N所围成的________空隙中,如果N与Cr核间距离为apm,则氮化铬的密度计算式为__________g·cm-3(NA表示阿伏加德罗常数的值)。
-
钛金属重量轻、强度高、有良好的抗腐蚀能力,其单质及其化合物在航空航天、武器装备、能源、化工、冶金、建筑和交通等领域应用前景广阔。回答下列问题:
(1)三氟化钛可用于制取钛氟玻璃,基态 F 原子核外有_____个未成对电子,Ti 原子形成Ti3+时价层电子层排布式为_____。
(2)TiO2 的熔点为 1800℃,TiCl4 的熔点为-25℃,则 TiO2 的晶体类型为_____,TiCl4 熔点低的原因为_____。
(3)钛某配合物可用于催化环烯烃聚合,其结如图所示:
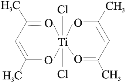
①钛的配位数为_____,该化合物中电负性最大元素是_____(填元素符号)。
②该配合物中不含有的化学键有_____(填字母标号)。
a.离子键 b.σ键 c.金属键 d.π键
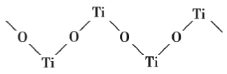
(4)已知 TiO2 与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为_____,阳离子中 O 的杂化方式为_____,阴离子的空间构型为_____。
(5)氮化钛可以用于制作电池的材料,其晶胞如图,该晶胞的密度为ρ g·cm-3,与氮原子最近的且距离相等的钛原子有_____个,氮原子与钛原子最近的距离为_____cm。

-
铝、钛、钡(第2主族)等元素在能源、材料等领域应用广泛。回答下列问题:
(1)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有___________种。基态Ti2+的最外层电子排布式为______________________。
(2)铝的逐级电离能数据为:I1=580kJ/mol、I2=1820 kJ/mol、I3=2750 kJ/mol、I4=11600kJ/mol。请分析数据规律,预测钡的逐级电离能的第一个数据“突跃”点出现在___________之间(用I1、I2、I3……等填空)
(3)已知第ⅡA族元素的碳酸盐MCO3热分解的主要过程是:M2+结合碳酸根离子中的氧离子。则CaCO3、BaCO3的分解温度较高的是___________(填化学式),理由是___________。
(4)催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图1所示。
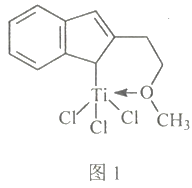
①M中,碳原子的杂化类型有___________。
②M中,不含___________(填标号)
A.π键 B.σ键 C.配位键 D.氢键 E.离子键
(5)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图2所示,为长方体。写出与AIH4-空间构型相同的一种分子___________(填化学式)。NaAlH4晶体中,与AlH4-紧邻且等距的Na+有___________个:NaAlH4晶体的密度为___________g/cm-3(用含a、NA的代数式表示)。
-
铝、钛、钡(第2主族)等元素在能源、材料等领域应用广泛。回答下列问题:
⑴与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有________种。基态Ti2+的最外层电子排布式为________________。
⑵铝的逐级电离能数据为:I1=580 kJ∙mol-1、I2=1820 kJ∙mol-1、I3=2750 kJ∙mol-1、I4=11600 kJ∙mol-1。请分析数据规律,预测钡的逐级电离能的第一个数据“突跃”点出现在________之间(用I1、I2、I3∙∙∙等填空 。
。
⑶已知第ⅡA族元素的碳酸盐MCO3热分解的主要过程是:M2+结合碳酸根离子中的氧离子。则CaCO3、BaCO3的分解温度较高的是________________(填化学式),理由是________________。
⑷催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图1所示。
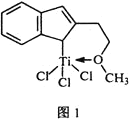
①M中,碳原子的杂化类型有________________。
②M中,不含________ 填标号
填标号 。
。
A. π键 B. δ键 C. 配位键 D.氢键 E. 离子键
⑸氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图2所示,为长方体。写出与AlH4-空间构型相同的一种分子_______________(填化学式)。NaAlH4晶体中,与AlH4-紧邻且等距的Na+有________个;NaAlH4晶体的密度为________ g∙cm-3(用含a、NA的代数式表示)。

CH3OH (g) △H1。已知:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1;CO(g)+H2O(g)==CO2(g)+H2(g) △H3=-41.1k J·mol-1.则△H1=___________ k J·mol-1。
CH3OH(g),平衡时,CO的转化率[α(CO)]随温度、压强的变化情况如图乙所示。
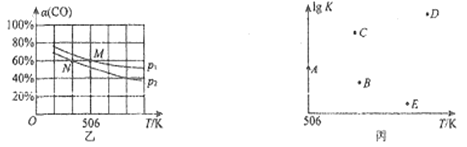
N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
















