-
目前铬被广泛应用于冶金、化工、铸铁及高精端科技等领域。回答下列问题:
(1)基态Cr原子价层电子的轨道表达式为_______,其核外有_______种不同能量的电子。
(2)Cr的第二电能离(ICr)和Mn的第二电离能(IMn)分别为1590.6 kJ·mol-1、1509.0 kJ·mol-1,ICr > IMn的原因是____________。
(3)过氧化铬CrO5中Cr的化合价为+6,则该分子中 键、
键、 键的数目之比为______。
键的数目之比为______。
(4)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___________。
(5)Cr的一种配合物结构如图所示,该配合物中碳原子的杂化方式是_______,阳离子中Cr原子的配位数为_________,ClO 的立体构型为________。
的立体构型为________。
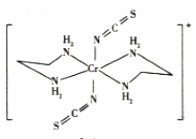
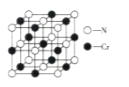
(6)氮化铬晶体的晶胞结构如图所示,Cr处在N所围成的________空隙中,如果N与Cr核间距离为apm,则氮化铬的密度计算式为__________g·cm-3(NA表示阿伏加德罗常数的值)。
-
铬是由法国化学家沃克兰于1798年在巴黎发现的。目前铬被广泛应用于冶金、化工、铸铁、耐火及高精端科技等领域。
(1)铬元素基态原子的电子排布式为____________,其核外未成对电子数为__________。
(2)金属铬的第二电离能(ICr)和锰的第二电离能(IMn)分别为1590.6kJ·mol-1、1509.0 kJ·mol-1,ICr>IMn的原因是__________。
(3)雷氏盐(Reinecke salt)的化学式为NH4[Cr(NCS)4(NH3)2].H2O是一种易溶于水和乙醇的暗红色固体。
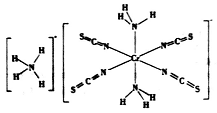
①雷氏盐中铬元素的化合价为_______,NH3与铬离子形成的化学键为__________。
②NCS-的立体构型是________,其中碳原子的杂化轨道类型为_______。SO2、CO2、BaCl2、SCl2四种分子中,与NCS-互为等电子体的是_____________。
③乙醇的沸点比溴乙烷高,其原因是__________。
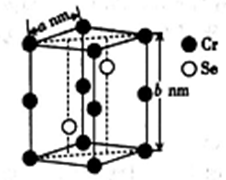
(4)硒化铬的晶胞结构如图所示,晶胞参数为anm和bnm,则硒化铬的密度为____________g·cm-3(列出表达式即可)。
-
氮及其化合物在科学研究和化工生产等领域都有着广泛的应用。请回答下列问题:
(1)与氮元素同族的第四周期元素的基态原子价层电子轨道表达式为___________。
(2)尿素分子的结构简式为:CO(NH2)2,该分子中σ键数目为___________,实验测得:分子中的所有原子在同一平面内,尿素中的碳氧键(125pm)比典型的碳氧双键(121pm)长,而尿素中的碳氮键(137pm)比典型的碳氮单键(147pm)短,说明分子中存在____________。
(3)氨分子构型为_________,氨晶体中,氨分子中的每个H 均参与一个氢键的形成,1 mol固态氨中有_____mol氢键。
(4)通常认为Cu3N是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。
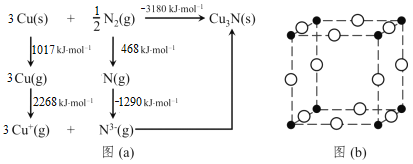
可知, Cu原子的第一电离能为_____kJ∙mol−1,N≡N键键能为_____kJ∙mol−1,Cu3N晶格能为_____kJ∙mol−1。
(5)Cu3N晶体的晶胞如图(b)所示。晶胞边长为anm,晶胞中N3- 位于Cu+所形成的正八 面体的体心,该正八面体的边长为____nm。
-
氮及其化合物在科学研究和化工生产等领域都有着广泛的应用。请回答下列问题:
(1)与氮元素同族的第四周期元素的基态原子价层电子轨道表达式为___________。
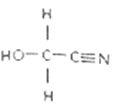
(2)HOCH2CN的结构简式如图,该分子中σ键与π键数目之比为___________,其分子中碳原子的杂化方式为___________,该物质中除氢以外的元素的第一电离能由大到小的顺序为______________________。
(3)[Cu(NH3)4]SO4是一种重要的配合物。与SO42-互为等电子体的分子的化学式为___________(任写一种)。NH3的 VSEPR模型为___________。[Cu(NH3)4]2+的结构可用示意图表示为______________________。
(4)①已知:2UO2+5NH4HF2 2UF4·NH4F+3NH3↑+4H2O↑,NH4HF2中不含有的作用力为___________(填选项字母)。
2UF4·NH4F+3NH3↑+4H2O↑,NH4HF2中不含有的作用力为___________(填选项字母)。
A.共价键 B.配位键 C.金属键 D.离子键 E.氢键
②NH3和H2O的键角由大到小的顺序为______________________(用分子式表示),原因是_______________________________________________________。
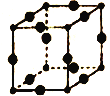
(5)Cu3N的晶胞结构如图所示,N3-的配位数为___________,Cu+半径为apm,N3-的半径为bpm,Cu3N晶胞的密度为___________g/cm3(列出计算式即可,阿伏加德罗常数的值用NA表示)。
-
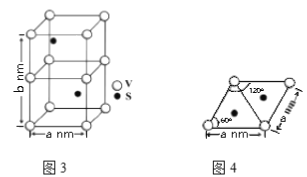
硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为__________,钒有+2、+3、+4、+5 等多种化合价,其中最稳定的化合价是______________,VO43-的几何构型为___________。
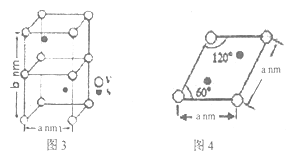
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。
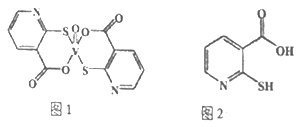
①该药物中S 原子的杂化方式是____________,所含第二周期元素第一电离能按由大到小顺序的排列是__________________。
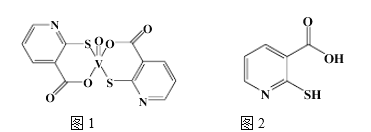
②2-巯基烟酸(图2)水溶性优于2-疏基烟酸氧钒配合物的原因是___________________。
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域П键”,下列物质中存在“离域П键”的是___________。
A.SO2 B.SO42- C.H2S D.CS2
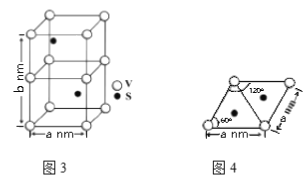
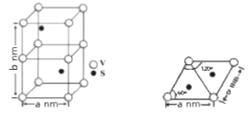
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为_____________。图4为该晶胞的俯视图,该晶胞的密度为________g/cm3 (列出计算式即可)。
-
硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为___________,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是________,VO43-的几何构型为________.
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。
①基态S原子中原子核外未成对电子数为_______,该药物中S原子的杂化方式是_______.所含第二周期元素第一电离能按由大到小顺序的排列是___________.
②2-巯基烟酸(图2) 水溶性优于2-巯基烟酸氧钒配合物的原因是_________.
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是_____.
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为______。图4 为该晶胞的俯视图,该晶胞的密度为________g/cm3 (列出计算式即可)。
-
硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为___________,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是________,VO43-的几何构型为________.
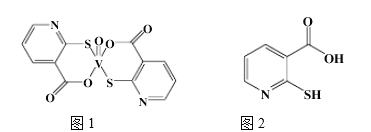
(2)2-巯基烟酸氧钒配合物(如图) 是副作用小的有效调节血糖的新型药物。
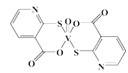
①基态S原子中原子核外未成对电子数为_______,该药物中S原子的杂化方式是_______.所含第二周期元素第一电离能按由大到小顺序的排列是___________。
②2-巯基烟酸如(图) 水溶性优于2-巯基烟酸氧钒配合物的原因是_________。

(3)下列含硫物质中存在Π键的是_____。
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如左图所示,该晶胞的化学式为______。右图为该晶胞的俯视图,该晶胞的密度为________g/cm3 (列出计算式即可)。
-
硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为___________,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是________,VO43-的几何构型为________.
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。
①基态S原子中原子核外未成对电子数为_______,该药物中S原子的杂化方式是_______.所含第二周期元素第一电离能按由大到小顺序的排列是___________.
②2-巯基烟酸(图2) 水溶性优于2-巯基烟酸氧钒配合物的原因是_________.
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是_____.
A.SO2 B.SO42- C.H2S D.CS2
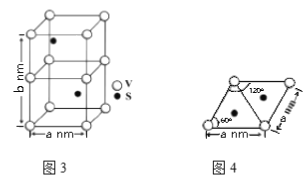
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为______。图4 为该晶胞的俯视图,该晶胞的密度为________g/cm3 (列出计算式即可)。
-
硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为___________,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是________,VO43-的几何构型为________.
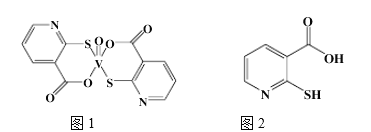
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。
①基态S原子中原子核外未成对电子数为_______,该药物中S原子的杂化方式是_______.所含第二周期元素第一电离能按由大到小顺序的排列是___________.
②2-巯基烟酸(图2) 水溶性优于2-巯基烟酸氧钒配合物的原因是_________.
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是_____.
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为______。图4 为该晶胞的俯视图,该晶胞的密度为________g/cm3 (列出计算式即可)。
-
铜和硫的化合物在化工、医药材料等领域具有广泛的用途。回答下列问题:
(1)原子轨道是指电子在原子核外的___________,基态S原子的原子轨道数是____个。
(2)基态Cu原子中,核外电子占据的原子轨道为球形的最高能级符号是______,占据该能级的电子数为__________。
(3)Cl、S、Se在元素周期表中处于相邻的位置,其第一电离能的大小顺序为_______。
(4)下图是含元素Cu、S的有机物的结构简式:
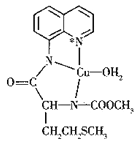
①该有机化合物结构中含有的化学键类型是_______(填“共价键““离子键”或“共价键、离子键”)、配位键,其中1个该有机物分子中配位键数为_____个,这些配位键中提供孤电子对的元素是__________。
②S原子的杂化方式为_______、带*N原子的杂化方式为_______。
(5)下图是Cu-Au合金的一种立方晶体结构:
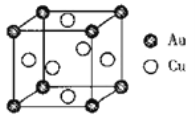
已知该合金的密度分dg/cm3,阿伏加德罗常数的值为NA,若Au原子的半径为bpm(lpm=10-10cm),则铜原子的半径为______cm(写出计算表达式)。
键、
键的数目之比为______。
的立体构型为________。


















