-
三元WO3/C3N4/Ni(OH)x光催化剂产氢机理如图。下列说法正确的是
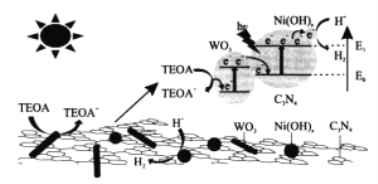
A. TEOA→TEOA+为还原反应
B. Ni(OH)x降低了H+→H2的活化能
C. 能量转化形式为太阳能→电能→化学能
D. WO3没有参与制氢反应过程
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值。下列关于反应“C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O”的说法正确的是
A. IL pH=2的H2SO4溶液中含有的H+数目为0.02NA
B. 含0.2molH2SO4的浓硫酸与足量炭充分反应生成气体分子总数为0.3NA
C. 生成SO24.48L(标况下)时转移电子数为0.4NA
D. 8.8gCO2中共用电子数目为0.8NA
难度: 中等查看答案及解析
-
Bhatti合成了调节中枢神经系统的药物其中间体为
。下列有关说法正确的是
A. 可发生氧化、中和反应 B. 与
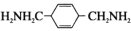 互为同分异构体
互为同分异构体C. 碳原子上的一氯代物共有7种(不含立体异构) D. 所有碳原子均处于同一平面
难度: 中等查看答案及解析
-
X、Y、Z、M为短周期元素,原子序数依次增大,Y、M同主族,X的简单氢化物遇M单质产生白烟,Z的氧化物与M的氢化物不反应,可与Y的氢化物反应。下列说法正确的是
A. X、Y、Z、M四种元素依次是N、O、P、S B. X、Y、Z原子半径依次增大
C. 四种元素中Z的氢化物稳定性最强 D. Z的化合物常用作无机非金属材料
难度: 中等查看答案及解析
-
实验室制备 NaClO2的装置如下图,其中C装置内生成ClO2下列说法正确的是
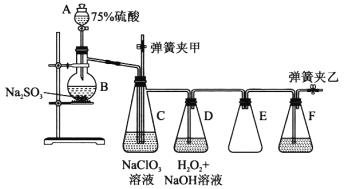
A. 实验开始时,应打开分液漏斗的活塞及弹簧夹乙,关闭弹簧夹甲
B. 可用98.3%硫酸代替75%硫酸
C. H2O2是制备 NaClO2反应的还原剂
D. F中的试剂可用饱和Ca(OH)2溶液
难度: 中等查看答案及解析
-
《 Journal of Energy Chemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是
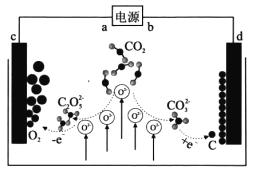
A. a为负极
B. 熔盐可用KOH溶液代替
C. d极电极反应式为CO32-+4e-===C+3O2-
D. 转移lmol电子可捕获CO211.2L(标况下)
难度: 中等查看答案及解析
-
25℃时,将SO2通入蒸馏水中模拟酸雨形成过程,实验数据如图。已知Ka1(H2SO3)=10-2,Ka2(H2SO3)=10-7。下列说法不正确的是
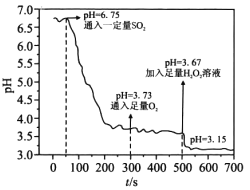
A. 300s未通O2时溶液中c(H2SO3)=10 -5.46mol·L-1
B. 400s时溶液中c(HSO3-)+c(SO32-)+c(SO42-)+c(H2SO3)≈10-3.73mol·L-1
C. 600s时,溶液中c(H+)约为c(SO42-)2倍
D. 由图推知,H2O2氧化性大于O2
难度: 中等查看答案及解析
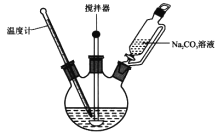



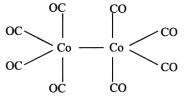
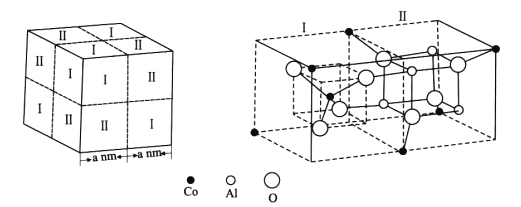
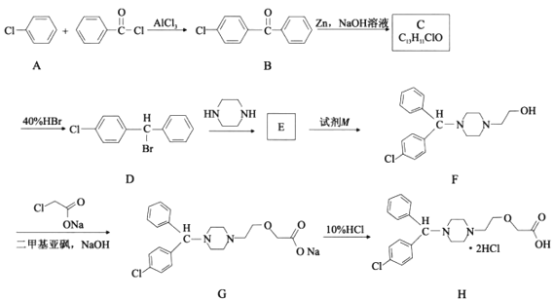
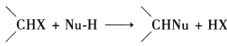 式中X为卤素原子;Nu-H为含氧或含氮原子的化合物;
式中X为卤素原子;Nu-H为含氧或含氮原子的化合物;
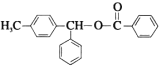 的合成路线(无机试剂任选)。___________
的合成路线(无机试剂任选)。___________