-
中华民族历史悠久,在浩瀚的历史文明中有许多关于化学的记载,下列说法不合理的是( )
选项
古代文献
记载内容
涉及原理
A
《淮南万毕术》
“曾青得铁则化为铜”
活泼金属置换不活泼金属
B
《鹤林玉露·一钱斩吏》
“一日一钱,千日千钱,绳锯木断,水滴石穿”
不涉及化学变化
C
《天工开物》
“凡火药,硫为纯阳,硝为纯阴”
纯阴指化合价降低,利用硝酸钾的氧化性
D
《肘后备急方》
“青蒿一握,以水二升渍,绞取汁”
利用物理方法提取青蒿素
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
国际计量大会第26次会议新修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法正确的是( )
A. 56g聚乙烯分子中含碳碳双键的数目为2 NA
B. 核聚变如21H+31H―→42He+10n,由于有新微粒生成,该变化是化学变化
C. 铅蓄电池放电时负极净增质量比正极净增质量多16g时转移电子数为NA
D. 1L0.5mlol·L-1Al2Fe(SO4)4溶液中阳离子数目小于1.5 NA
难度: 困难查看答案及解析
-
以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下:

下列说法正确的是
A. 粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B. 电解时用粗银作阴极,硝酸银溶液为电解质溶液
C. 用稀硫酸处理渣料时主要发生了氧化还原反应
D. 从滤液B中可以提取绿矾(FeSO4·7H2O)
难度: 中等查看答案及解析
-
已知某有机物含有4个C,每个C原子都以键长相等的三条单键连接3个C,且整个结构中所有碳碳键之间的夹角都为60°,则下列说法不正确的是 ( )
A. 该有机物的分子式为C4H4 B. 该有机物不存在
C. 该有机物的空间构型为正四面体 D. 该有机物不属于苯的同系物
难度: 中等查看答案及解析
-
aL体积比为1∶3的A、B两种链烃的混合气体,可与0.5aL(状态相同)氢气发生加成反应,则A、B两种链烃的通式可能是( )
A. CnH2n-2和CnH2n+2 B. C nH2n和CnH2n+2
C. CnH2n和CnH2n D. CnH2n和CnH2n-2
难度: 中等查看答案及解析
-
已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )
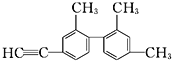
A. 分子中处于同一直线上的碳原子最多有6个
B. 该烃苯环上的二氯代物共有13种
C. 该烃的一氯代物共有8种
D. 分子中至少有12个碳原子处于同一平面上
难度: 困难查看答案及解析
-
某化工厂排放出大量含硫酸铵的废水,技术人员设计如图所示装置处理废水中的硫酸铵,并回收化工产品硫酸和氨水,废水处理达标后再排放。下列说法错误的是

A. 离子交换膜1为阳离子交换膜,Y极发生氧化反应
B. a口进入稀氨水,d口流出硫酸
C. 阳极的电极反应式为2H2O-4e-=4H++O2↑
D. 对含硫酸铵较多的废水处理过程中若转移0.2mol电子,则可回收19.6gH2SO4
难度: 中等查看答案及解析
-
下列解释实验事实的方程式不正确的是( )
A. 用Na2S处理含Hg2+的废水:Hg2++S2-=HgS↓
B. 稀HNO3洗涤做过银镜反应的试管:3Ag +4H+ + NO3− == 3Ag+ + NO↑ + 2H2O
C. 向硫酸铜溶液中加入过氧化钠:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
D. 向碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
难度: 中等查看答案及解析
-
在常温下,用0.1000 mol/L的盐酸滴定25 mL 0.1000 mol/L Na2CO3溶液,所得滴定曲线如下图所示。下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是
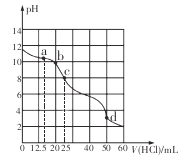
A. a点:c( HCO3-)>c(Cl-)>c(C032-)
B. b点:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+c(CO32-)+c(OH-)
C. c点:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
D. d点:c(Cl-)=c(Na+)
难度: 困难查看答案及解析
-
芳香化合物M的结构简式为
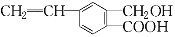 ,关于有机物M的说法正确的是( )
,关于有机物M的说法正确的是( )A. 有机物M的分子式为C10H12O3
B. 1 mol Na2CO3最多能消耗1 mol有机物M
C. 1 mol M和足量金属钠反应生成22.4 L气体
D. 有机物M能发生取代、氧化、加聚和缩聚等反应
难度: 中等查看答案及解析
-
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )
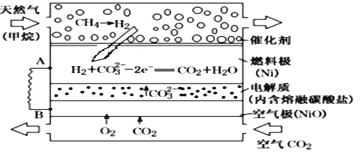
A. 以此电池为电解精炼铜,当有0.1 mol e-转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时,负极反应式为CH4+5O2--8e-===CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为:O2+4e-+2CO2 = 2CO32-
难度: 困难查看答案及解析
-
常温下,向20mL0.lmol·L-1NH4HSO4溶液中滴入0.1mol·L-1NaOH溶液,溶液中由水电离出的c水(H+)与所加NaOH溶液的体积的关系如图所示。下列分析正确的是

A. b点时,溶液的pH=7
B. 常温下,Kb(NH3·H2O)=1.0×10-5.3
C. Vd<30 mI
D. e点溶液中粒子浓度由大到小的顺序为c(Na+)>c(SO42-)>c(NH4+)>c(NH3·H2O )>c(OH- )>c(H+)
难度: 中等查看答案及解析
-
分子式为C10H20O2的有机物在酸性条件下可水解为醇A和酸B,A经过连续氧化可转化为B,若不考虑立体异构,符合上述要求的醇和酸若重新组合,可形成的酯共有
A.32 B.16 C.8 D.4
难度: 困难查看答案及解析
-
a mol H2和b mol C2H2在密闭容器中反应,当其达到平衡时,生成c mol C2H4,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量为
A. (
)mol B. (a+3b)mol
C. (
)mol D. (a+3b+2c)mol
难度: 中等查看答案及解析
-
分液漏斗中液体为甲、锥形瓶内物质为乙、试剂瓶中液体为丙,利用烧杯内液体吸收尾气。用图中装置进行实验,其实验目的或现象都正确的是
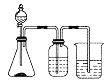
选项
甲
乙
丙
实验目的或现象
A
稀硫酸
碳酸钠
硅酸钠溶液
验证硫、碳、硅的非金属性
B
浓盐酸
二氧化锰
溴化钠溶液
验证氯气和溴单质的氧化性强弱
C
浓氨水
氧化钙
氯化铝溶液
观察出现白色沉淀,后沉淀溶解
D
浓硫酸
亚硫酸钠
溴水
验证二氧化硫的漂白性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如右图所示。活化氧可以把SO2快速氧化为SO3。下列说法错误的是( )
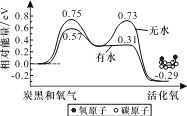
A. 每活化一个氧分子吸收0.29 eV的能量
B. 水可使氧分子活化反应的活化能降低0.18eV
C. 氧分子的活化是O—O键的断裂与C—O键的生成过程
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
难度: 困难查看答案及解析
-
I2在水中溶解度很小,在KI溶液中溶解度显著增大,其原因是I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I3-(aq)。某I2、KI混合溶液中,I3-的浓度c(I3-)与温度(T)的关系如图所示(曲线上的任一点都表示平衡状态)。下列说法正确的是( )

A. 反应I2(aq)+I-(aq)
I3-(aq) 的ΔH>0
B. 在上述平衡体系中加入CCl4,平衡不移动
C. 保持T1不变,若反应进行到d点时,一定有v正>v逆
D. T2 ℃时,在上述平衡体系中加入少量KI固体后,平衡常数K增加
难度: 困难查看答案及解析
-
常温下,将AgNO3溶液分别滴加到浓度均为0.01 mol/L的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、SeO32-用Xn-表示,不考虑SeO32-的水解)。下列叙述正确的是
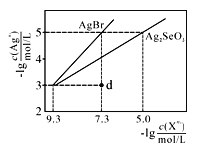
A. Ksp(Ag2SeO3)的数量级为10-10
B. d点对应的AgBr溶液为不饱和溶液
C. 所用AgNO3溶液的浓度为10-3 mol/L
D. Ag2SeO3(s)+2Br-(aq)==2AgBr(s)+SeO32- (aq)平衡常数为109.6,反应趋于完全
难度: 中等查看答案及解析