-
常温下,下列各组离子在指定溶夜中一定能大量共存的是
A. 在水溶夜中: H+、I-、NO3-、SiO32-
B. 饱和氯水中: Cl-、NO3-、Na+、SO32-
C. 在酸性溶夜中: Cl-、NH4+、Al3+、SO42-
D. 加入金属铝产生H2的溶液中: NH4+、Na+、SO42-、CO32-
难度: 中等查看答案及解析
-
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是( )
①a-b=m-n
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
A. ②③ B. ③ C. ①②③④ D. ①②③
难度: 中等查看答案及解析
-
下列说法正确的为( )
A. 12C、13C、14C、金刚石、石墨都是碳元素的同位素
B. 同种元素的原子,质量数一定相同
C. 互为同位素的原子,质子数一定相同
D. 由一种元素组成的物质,一定是纯净物
难度: 简单查看答案及解析
-
下列表述正确的是( )
① Al(OH)3和 Na2CO3均可以用于治疗胃酸过多
② 化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③ 提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④ 水晶项琏和餐桌上的瓷盘都是硅酸盐制品
⑤大阳能电池可采用硅材料制作,其应用有利于环保、节能
A. ①②③ B. ①③⑤ C. ③④⑤ D. ③⑤
难度: 简单查看答案及解析
-
下列物质中既能与稀硫酸反应,又能与氢氧化钠溶液反应的是( )
①NaHCO3 ②(NH4)2SO3 ③Al2O3 ④Al(OH)3 ⑤Al ⑥NaHSO4 ⑦AlCl3 ⑧Na2SiO3
A. ①②③④⑤⑦ B. ①③④⑤ C. ①②③④⑤ D. ②③④⑤⑥⑧
难度: 中等查看答案及解析
-
将过量的CO2分别通入①CaC12溶液,②Na2SiO3溶液;③石灰水溶液,④饱和Na2CO3溶液,最终有沉淀析出的是( )
A. ①②③④ B. ②④ C. ①②③ D. ②③
难度: 中等查看答案及解析
-
下列各组物质混合后,再加热蒸干并充分灼烧至质量不变,最终产物一定是纯净物的是( )
A. 向Na[Al (OH )4]溶液中加入过量的盐酸
B. 向KI和KBr 溶液中通入足量Cl2
C. 向FeSO4溶液中加入足量的NaOH 溶液
D. 向NaHCO3 溶液中加入Na2O2 粉末
难度: 简单查看答案及解析
-
将某些化学知识用图象表示,可以收到直观、简明的效果。下列图象所表示的化学知识中,不正确的是( )
A. 分散系分类

B. 醋酸稀释

C. 向碳酸钠溶液中逐滴加入盐酸

D. 向氯化铝溶液中滴加过量的NaOH溶液
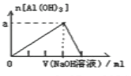
难度: 中等查看答案及解析
-
下列物质暴露在空气中不容易变质的是( )
A. 水玻璃 B. 石灰水 C. 生石灰 D. 小苏打
难度: 中等查看答案及解析
-
下列物质可以实现一步转化的是( )
A. N2→NO2→HNO3→NH4Cl B. Al→Al2O3→Al(OH)3→AlCl3
C. Cu→CuCl2→Cu(OH)2→CuO D. Si→SiO2→H2SiO3→NaSiO3
难度: 中等查看答案及解析
-
能说明Cl的非金属性比S强的事实有( )
①常温下S为固体,而Cl2为气体
②Cl2与H2混合,强光照射剧烈反应;而S与H2反应需较高温度
③与Fe反应,Cl2生成FeCl3,而S生成FeS
④盐酸是强酸,而氢硫酸是弱酸
⑤将Cl2通入氢硫酸中可置换出S
A. ①③⑤ B. ②③④⑤ C. ②③⑤ D. ②④⑤
难度: 简单查看答案及解析
-
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述不正确的是
元素代号
A
B
C
D
E
F
G
原子半径/nm
0.182
0.160
0.089
0.143
0.102
0.099
0.071
主要化合价
+1
+2
+2
+3
+6.-2
-1
-1
A. 气态氢化物的稳定性HG>HF>H2E
B. A+、B2+、D3+、G-四种离子的核外电子排布相同
C. A与氧气反应的产物之一A2O2,阴离子和阳离子的比例为1:1
D. C元素的原子最外层电子数等于电子层数
难度: 中等查看答案及解析
-
五种短周期主族元素A、B、C、D、E的原子序数依次增大,A2属于绿色燃料,C的氧化物用于生产光导纤维,D元素原子的核电荷数是同主族上一周期元素的2倍,B、C为同周期元素,B、D原子最外层电子数之和等于E的最外层电子数. 根据以上叙述,下列说法中正确的是
A. 五种元素中有两种金属元素
B. 元素C、D、E的最高价氧化物对应水化物的酸性增强
C. 元素D、E分别与元素A形成化合物的稳定性:A2D>AE
D. 元素B、D、E的简单离子半径大小为:B>D>E
难度: 中等查看答案及解析
-
下列实验操作不能达到实验目的的是( )
选项
实验操作
实验目的
A
某溶液做焰色反应,为黄色
证明此溶液一定为钠盐
B
将二氧化碳通入硅酸钠溶液中,产生白色沉淀
证明碳酸的酸性强于硅酸
C
把铝箔在酒精灯上加热到熔化,熔化后的液态铝不会滴落下来
证明Al2O3的熔点比Al高
D
将Fe(OH)3胶体过滤后所得滤液置于暗处,再用激光笔照射滤液,产生丁达尔现象
证明胶体的分散质能透过滤纸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知CeO2通常既不溶于强酸,也不溶于强碱。某工厂以平板电视显示屏厂的废玻璃粉末(含CeO2、SiO2、Fe2O3、FeO等物质)为原料,设计如下图所示工艺流程,制得纯净的CeO2。下列说法正确的是( )
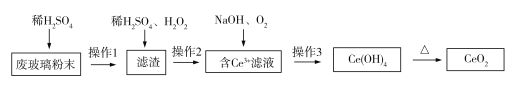
A. 实验室中,操作3和操作1、操作2所用仪器不同
B. 滤渣中加入稀H2SO4和H2O2,其中H2O2做氧化剂
C. 滤液中Ce3+与NaOH、O2的反应属于化合反应
D. 操作2分离得到的滤渣中一定含有未反应的SiO2
难度: 简单查看答案及解析