-
化学与生产、生活密切联系.下列有关说法正确的是( )
A. 光导纤维是一种新型的有机高分子材料
B. 二氧化硫有毒,禁止用作葡萄酒添加剂
C. 燃料电池是利用燃料在电池中燃烧实现热能转化为电能
D. 港珠澳大桥使用新一代环氧涂层钢筋,可有效抵御海水浸蚀
难度: 简单查看答案及解析
-
最近我国科学家研制一种具有潜力的纳米电子学材料——石墨炔,图中丁为它的结构片段。下列有关说法中,错误的是( )

A. 甲分子中的6个溴原子位于同一平面上
B. 丙的二氯代物有2种
C. 丙能使酸性高锰酸钾溶液褪色
D. 石墨炔和C60是碳的同素异形体
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法确的是( )
A. 1mol乙醇完全氧化为乙酸,转移电子数为4NA
B. 标准状况下,22.4L乙烯中含有的共用电子对数目为5NA
C. 3.6gD2O与足量的金属钠反应,生成的D2分子数0.1NA
D. 在1mol/L的NaF溶液中,F—的个数为NA
难度: 中等查看答案及解析
-
四种不同主族的短周期元素X、Y、Z、W的原子序数依次递增,X与Y形成的化合物是光合作用的原料之一。Z、W处于同周期且族序数相差6。下列说法正确的是( )
A. 元素的非金属性:X>W
B. Y与Z形成的化合物中只含有离子键
C. Z、W的简单离子半径:Z<W
D. 只有W元素的单质可用于自来水的杀消毒
难度: 中等查看答案及解析
-
下列实验可以达到目的的是( )
选项
实验目的
实验过程
A
探究浓硫酸的脱水性
向表面皿中加入少量胆矾,再加入约3m1浓硫酸,搅拌,观察实验现象
B
制取干燥的氨气
向生石灰中滴入浓氨水,将产生的气体通过装有P2O5的干燥管
C
制备氢氧化铁胶体
向饱和氯化铁溶液中滴加氨水
D
除去MgCl2溶液中少量FeCl3
向溶液中加入足量MgO粉末,充分搅拌后过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
钠离子二次电池因钠资源丰富、成本低、能量转换效率高等诸多优势有望取代锂离子电池。最近山东大学徐立强教授课题组研究钠离子二次电池取得新进展,电池反应如下:4NaXFeIIFeIII(CN)6+xNi3S2
4FeIIFeIII(CN)6+3xNi+2xNa2S。下列说法正确的是( )
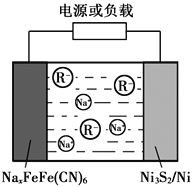
A. 放电时,NaXFeIIFeIII(CN)6为正极
B. 放电时,Na+移向Ni3S2/Ni电极
C. 充电时,Na+被还原为金属钠
D. 充电时,阴极反应式:xNa++ FeIIFeIII(CN)6-xe—== NaXFeIIFeIII(CN)6
难度: 中等查看答案及解析
-
恒温25℃下,向一定量的0.1mol/L的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-1gc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )
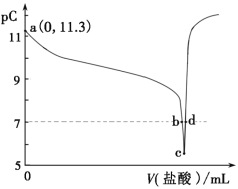
A. BOH为弱碱且Kb的数量级为10—5
B. b点溶液呈中性
C. c-d点间溶液中:c(BOH)+c(OH—)>c(H+)
D. c点溶液中水的电离程度最大,且c(B+)<c(Cl—)
难度: 困难查看答案及解析

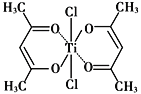
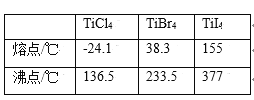
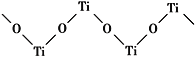
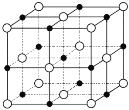
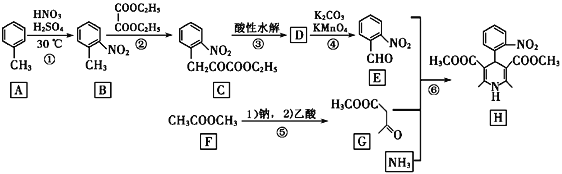
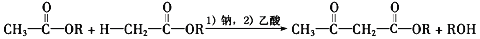
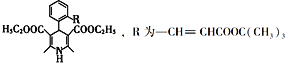 也是一种治疗高血压药物,设以乙醇和
也是一种治疗高血压药物,设以乙醇和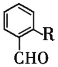 为原料制备拉西地平的合成路线(无机试剂任选)。________________________
为原料制备拉西地平的合成路线(无机试剂任选)。________________________