-
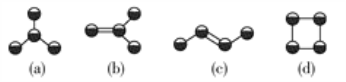
如图是四种常见有机物的比例模型示意图。下列说法正确的是( )

A. 甲能使酸性KMnO4溶液褪色
B. 乙可与溴水发生取代反应而使溴水褪色
C. 丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特键
D. 丁只能发生取代反应
难度: 中等查看答案及解析
-
某烯烃(只含有1个双键)与H2加成后的产物是CH3CH(CH3)CH(CH3)C(CH3)3,则该烯烃的结构式可能有( )
A. 1种 B. 2种 C. 3种 D. 4种
难度: 中等查看答案及解析
-
下列是四种烷烃分子的球棍模型或结构简式,其中沸点最高的是( )
A.
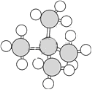 B. CH3CH2CH2CH2CH2CH3 C. CH3CH2CH2CH2CH3 D. CH3CH2CH3
B. CH3CH2CH2CH2CH2CH3 C. CH3CH2CH2CH2CH3 D. CH3CH2CH3难度: 简单查看答案及解析
-
下列关于物质的制备、鉴别与除杂的说法正确的是( )
A. 乙烷中混有少量乙烯:通入氢气在一定条件下反应,使乙烯转化为乙烷
B. 氯气与甲烷按照比例2:1在光照条件下反应制备纯净的二氯甲烷
C. 只用溴水就能将苯、己烯、四氯化碳、淀粉碘化钾溶液区分开来
D. 苯与溴水混合后加入FeBr3,发生放热反应,制备密度大于水的溴苯
难度: 困难查看答案及解析
-
分子式为C4H9Cl的有机物,其同分异构体的数目有( )
A. 1种 B. 2种 C. 3种 D. 4种
难度: 简单查看答案及解析
-
下列物质间在一定条件下发生反应,主要为取代反应类型的是( )
A. 乙烯在一定条件下变成聚乙烯 B. 甲烷和氯气混合光照
C. 乙醇使酸性高锰酸钾褪色 D. 乙烯通入浓溴水中
难度: 简单查看答案及解析
-
一定温度下,在固定体积的密闭容器中发生反应:2HI(g)
H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是( )
A. 当HI、H2、I2浓度之比为2:1:1时,说明该反应达平衡
B. c(HI)由0.07mol/L降到0.05mol/L所需的反应时间小于10s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.001mol/(L·s)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 吸热反应的反应物的总能量之和大于生成物的总能量之和
C. Ba(OH)2·8H2O与NH4Cl的反应是放热反应
D. 碳高温下与CO2反应是吸热反应
难度: 简单查看答案及解析
-
10mL某气态烯烃在50mLO2里充分燃烧,得到液态水和体积为35mL的混合气体(同温同压下测定),该气态烯烃是( )
A. 乙烯 B. 丙烯 C. 1-丁烯 D. 2-丁烯
难度: 中等查看答案及解析
-
将氨水缓缓地滴入到盐酸中至中性,下列有关说法①盐酸过量 ②氨水过量 ③c(Cl-)>c(NH4+)④c(Cl-)=c(NH4+)⑤c(Cl-)<c(NH4+)正确的是( )
A. ①⑤ B. ①③ C. ②④ D. ②⑤
难度: 中等查看答案及解析
-
下列物质中含有共价键的离子化合物是( )
①MgCl2 ②Na2O2 ③NaOH ④NH4Cl ⑤CO2 ⑥H2O2 ⑦N2
A. ②③④ B. ②④⑤⑦ C. ①②③④⑥ D. ①③⑤⑥
难度: 中等查看答案及解析
-
下列变化中,需加还原剂才能实现的是( )
A. CuSO4→Cu B. Mg→Mg3N2 C. S→SO2 D. SiO2→Na2SiO3
难度: 中等查看答案及解析
-
定容容器中发生反应I2(g)+H2(g)
2HI(g),下列措施不能提高其反应速率的是
A. 升高温度 B. 使用催化剂
C. 充入稀有气体,增大体系压强 D. 增加I2和H2的起始量
难度: 中等查看答案及解析
-
已知稀溶液中H+(aq)+OH-(aq)=H2O(l),生成1 mol H2O(l)放出57.3 kJ热量。下列过程中放出热量为57.3 kJ的是( )
A. 1 mol H2SO4与足量的NaOH溶液反应
B. 稀盐酸与氨水反应生成1 mol H2O(l)
C. 稀盐酸与稀Ba(OH)2溶液反应生成1 mol H2O(l)
D. 稀NaOH与98%浓硫酸反应生成1 mol H2O(l)
难度: 简单查看答案及解析
-
LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
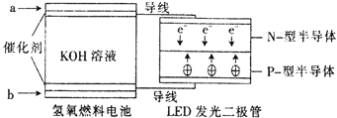
A. a外通入氧气,b处通氢气
B. 通入H2的电极发生反应:H2−2e−===2H+
C. 通入O2的电极发生反应:O2+4e−+2H2O===4OH−
D. 该装置将化学能最终转化为电能
难度: 困难查看答案及解析
-
有机物的种类繁多,但其命名是有规则的。下列有机物命名正确的是( )
A.
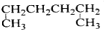 1,4—二甲基丁烷 B.
1,4—二甲基丁烷 B. 3—甲基丁烯
C.
2—甲基丁烷 D. CH2Cl- CH2Cl二氯乙烷
难度: 中等查看答案及解析