-
若ABn的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥理论,下列说法正确的是( )
A. 若n=2,则分子的空间构型为V形
B. 若n=3,则分子的空间构型为三角锥型
C. 若n=4,则分子的空间构型为正四面体型
D. 以上说法都不正确
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下,则下列有关比较中正确的是( )。
①1s22s2 2p63s23p4; ②1s22s22p63s23p3; ③1s22s2 2p3; ④1s22s22p5。
A. 第一电离能:④>③>②>① B. 原子半径:④>③>②>①
C. 电负性:④>③>②>① D. 最高正化合价:④>③=②>①
难度: 中等查看答案及解析
-
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A.:He B.
C.1s2 D.
难度: 中等查看答案及解析
-
下列电子排布式中,原子处于激发态的是( )
A. ls22s22p63s23p63d34s2
B. ls22s22p63s23p63d44s2
C. ls22s22p63s23p63d54s2
D. ls22s22p63s23p63d64s2
难度: 简单查看答案及解析
-
下列氧原子的轨道表示式中,能量最低的是
A.
 B.
B.  C.
C.  D.
D. 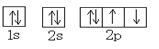
难度: 中等查看答案及解析
-
下列有关元素周期表的叙述正确的是( )
A. 原子半径最小的是F B. 所含元素种类最多的族是第VIII族
C. 金属元素的种类多于非金属元素 D. 第n周期第n主族的元素均为金属
难度: 简单查看答案及解析
-
以下各分子中所有原子都满足最外层为8电子结构的是
A. CCl4 B. BF3 C. NH3 D. PCl5
难度: 中等查看答案及解析
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A. X与Y形成化合物是,X可以显负价,Y显正价
B. 第一电离能可能Y小于X
C. 最高价含氧酸的酸性:X对应的酸性弱于Y对应的
D. 气态氢化物的稳定性:HmY小于HnX
难度: 简单查看答案及解析
-
外围电子构型为4f75d16s2的元素在周期表中的位置应是
A. 第四周期ⅦB族
B. 第五周期ⅢB族
C. 第六周期ⅦB族
D. 第六周期ⅢB族
难度: 中等查看答案及解析
-
下列各组原子中,彼此化学性质一定相似的是
A. 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B. 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C. 2p轨道上只有一个未成对的电子(不含成对电子)的X原子与3p 轨道上只有一个未成对的电子(不含成对电子)的Y原子
D. 最外层都只有一个电子的X、Y原子
难度: 中等查看答案及解析
-
根据表中的数据,从电负性的角度判断下列元素之间易形成共价键的一组是( )
元素
Na
Mg
Al
H
C
O
Cl
电负性
0.9
1.2
1.5
2.1
2.5
3.5
3.0
①Na和Cl ②Mg和Cl ③Al和Cl ④H和O ⑤Al和O ⑥C和Cl
A. ①②⑤ B. ③④⑥ C. ④⑤⑥ D. 全部
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 乙烯分子中σ键比π键重叠度大,形成的共价键强
B. 两个原子之间形成共价键时,最多有1个σ键
C. 气体单质中,一定有σ键,可能有π键
D. N2分子中有一个σ键,2个π键
难度: 中等查看答案及解析
-
下列说法正确的是
A. 并非所有的共价键都有方向性
B. H2O与 H2S 的空间结构一样是由共价键的饱和性决定的
C. Cl2是双原子分子,H2S 是三原子分子,这是由共价键的方向性决定的
D. 两原子轨道发生重叠后,电子出现在两核间的概率减小
难度: 中等查看答案及解析
-
下列化合物分子中一定既含单键又含双键的是
A. CO2 B. C2H6O C. COCl2 D. H2O2
难度: 中等查看答案及解析
-
根据等电子原理,下列各组分子或离子的空间构形不相似的是
A. SO2与O3 B. NH4+和CH4 C. H3O+与NH3 D. CO2与H2O
难度: 简单查看答案及解析
-
下列分子中,中心原子的杂化轨道类型相同的是
A. CO2与SO2 B. CH4与NH3
C. H2O2与C2H4 D. C2H4与N2H4
难度: 中等查看答案及解析
-
A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若 A 元素的原子序数为 a,则 B 元素的原子序数可能为( )
A. a-4 B. a-5 C. a-6 D. a+4
难度: 困难查看答案及解析
-
下面是从实验中测得的不同物质中氧氧键的键长和键能的数据:
O—O键
O22-
O2-
O2
O2+
键长/10-12 m
149
128
121
112
键能/kJ·mol-1
x
y
z=494
w=628
其中x、y的键能数据尚未测定,但可根据规律推导出键能的大小顺序为w>z>y>x。则该规律是( )
A. 键长越长,键能越小
B. 成键所用的电子数越多,键能越大
C. 成键所用的电子数越少,键能越大
D. 成键时共用电子越偏移,键能越大
难度: 中等查看答案及解析
-
下列关于雷酸(H-O-N≡C)和氰酸(H-O-C≡N )及其组成元素的说法错误的是( )
A. 两者互为同分异构体
B. 两种分子中的所有原子都在一条直线上
C. 电负性:O>N>C>H
D. 第一电离能:N>O>C
难度: 中等查看答案及解析
 ___________;
___________; ______________。
______________。