-
下列危险化学品标志中最适合用于Na2O2固体的是( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
下图所示装置在中学实验中有很多用途,可根据实验目的在广口瓶中盛放适量某试剂。下面有关其使用有误的是( )
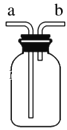
A. 瓶内装饱和食盐水,可用于除去氯气中的HCl气体,气体应a进b出
B. 瓶内装水,可用于除去NO气体中的NO2气体,气体应a进b出
C. 瓶口朝上,可用于收集NH3,气体应b进a出
D. 瓶口朝下,可用于收集CH4气体,气体应b进a出
难度: 中等查看答案及解析
-
下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
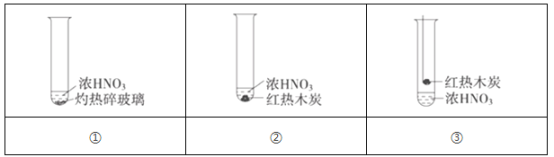
A. 由①中的红棕色气体,推断浓硝酸受热易分解,应保存在低温阴暗处
B. 红棕色气体不能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
难度: 中等查看答案及解析
-
下列实验操作不正确的是( )
A. 滴定前用待测液润洗锥形瓶
B. 容量瓶和滴定管使用前均需要检漏
C. 蒸馏完毕时,先停止加热,再关闭冷凝水
D. 分液时,下层溶液先从下口放出,上层溶液再从上口倒出
难度: 简单查看答案及解析
-
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是
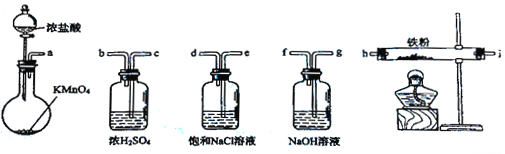
A. a-b-c-d-e-e-f-g-h B. a-e-d-c-b-h-i-g
C. a-d-e-c-b-h-i-g D. a-c-b-d-e-h-i-f
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为
。下列说法正确的是
A. 1L0.1mol·
NH4Cl溶液中,
的数量为0.1
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2
难度: 困难查看答案及解析
-
下图是先用浓硫酸与乙醇反应制取乙烯,再由乙烯与Br2反应制备1,2-二溴乙烷(熔点:9.5℃,沸点:131℃)的反应装置(加热和加持装置略去),下列说法错误的是( )
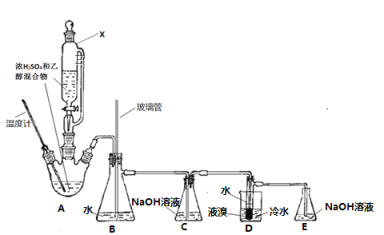
A. 仪器X使用前要先拔掉上口的玻璃塞
B. 装置B的作用是防堵塞安全作用
C. 若略去装置C,会使液溴部分损耗
D. 装置E是尾气处理装置,主要吸收尾气中的溴蒸气,防止污染环境
难度: 中等查看答案及解析
-
下列由实验得出的结论正确的是( )
实验
结论
A.
将乙醇-浓硫酸混合液在170℃下加热产生的气体通入酸性高锰酸钾溶液,溶液最终变为无色透明
生成乙烯可与酸性高锰酸钾溶液反应
B.
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
C.
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
D.
将盛有物质的量比为1:4的甲烷与氯气的混合气体的试管倒插入饱和食盐水中,在光源照射下一段时间,试管内液面上升,但未能充满试管
生成的氯代甲烷中有不溶于水的气体
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
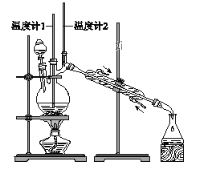
物质
沸点/℃
密度/(g·cm-3)
水中溶解性
正丁醇
117.2
0.8109
微溶
正丁醛
75.7
0.8017
微溶
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
难度: 困难查看答案及解析
-
某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:

下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
难度: 中等查看答案及解析
-
我国科学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔生理学或医学奖。研究团队发现在温度较高时未能提取到青蒿素,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。下面反应是青蒿素在一定条件下转化为双氢青蒿素:
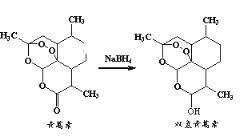
以下说法不正确的是( )
A. 较高温度下未能提取到青蒿素的原因与分子中存在非极性的O—O键的不稳定性有关
B. 青蒿素和双氢青蒿素均能使湿润的淀粉-碘化钾试纸变蓝色
C. 双氢青蒿素比青蒿素的水溶性好,所以治疗疟疾的效果更好
D. 青蒿素属于酯类化合物,分子中碳原子采用sp3杂化
难度: 中等查看答案及解析
-
实验室提纯含少量氯化钠杂质的硝酸钾的过程如右图所示。下列分析正确的是
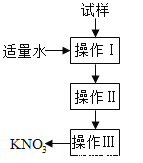
A. 操作Ⅰ是过滤,将固体分离除去 B. 操作Ⅱ是加热浓缩、趁热过滤,除去杂质氯化钠
C. 操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 D. 操作Ⅰ~Ⅲ总共需两次过滤
难度: 中等查看答案及解析
-
无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1。已知:Mg与Br2反应剧烈放热;MgBr2具有强吸水性。下列说法错误的是( )
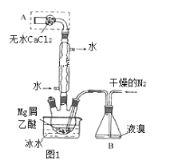
A. 实验必须要缓慢通入干燥的N2以免反应过于剧烈
B. 若用干燥的空气代替干燥的N2,其主要的缺点是制得的MgBr2中含有杂质。
C. 装有无水CaCl2固体A的作用是防止外界水蒸气进入反应装置
D. 冷凝管起冷凝回流作用,可防止乙醚、溴等的挥发
难度: 困难查看答案及解析
-
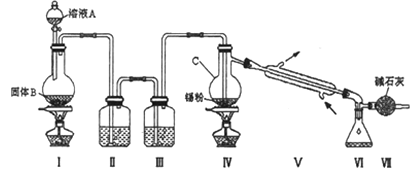
MnSO4是制备高纯MnCO3的中间原料。实验室用如图所示装置可制备少量MnSO4溶液,反应原理为:MnO2+H2SO3=MnSO4+H2O;下列说法错误的是( )

A. 缓慢通入混合气体可提高SO2的转化率
B. 若不通N2,则烧瓶中的进气管口容易被堵塞
C. 若实验中将N2换成空气,则反应液中c(Mn2+)/c(SO42-)的浓度之比变大
D. 石灰乳对尾气的吸收效果比澄清石灰水更好
难度: 困难查看答案及解析
-
下列实验仪器的使用不正确的是( )
A

该仪器为滴定管,可用来盛装NaOH溶液
B

该仪器为酒精喷灯,用于高温加热
C
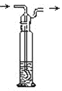
该仪器为洗气瓶,可用于气体的除杂
D

该仪器为吸滤瓶,可用于减压过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某小组为探究草酸亚铁(FeC2O4)的热分解产物,按下面所示装置进行实验。以下说法错误的是
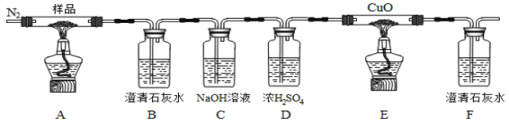
A. 实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO气体
B. 反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C. 装置C的作用是除去混合气中的CO2
D. 反应结束后,应熄灭A、E处酒精灯后,持续通入N2直至温度恢复至室温
难度: 困难查看答案及解析
-
根据价层电子对互斥模型,判断下列分子或者离子的空间构型不是三角锥形的是( )
A. PCl3 B. HCHO
C. H3O+ D. PH3
难度: 中等查看答案及解析
-
若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
A. 氢键分子间作用力非极性键 B. 氢键氢键极性键
C. 氢键极性键分子间作用力 D. 分子间作用力氢键非极性键
难度: 简单查看答案及解析
-
某晶体的部分结构如图所示,这种晶体中A、B、C三种粒子数之比是( )

A. 3:9:4 B. 1:4:2
C. 2:9:4 D. 3:8:4
难度: 中等查看答案及解析
-
下列关系正确的是( )
A. 在a mol金刚石中含有C—C键的个数为N= 2a×6.02×1023
B. 热稳定性:MgCO3 > CaCO3
C. 熔点:MgO < MgCl2
D. 沸点:Na < K
难度: 中等查看答案及解析
-
观察下列模型并结合有关信息进行判断,下列说法错误的是( )
HCN
S8
SF6
B12结构单元
结构模型示意图


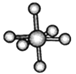

备注
/
易溶于CS2
/
熔点1873 K
A. HCN的结构式为H—C≡N,分子中“C≡N”键含有1个σ键和2个π键
B. 固态硫S8属于原子晶体,分子中S原子采用sp3杂化
C. SF6是由极性键构成的非极性分子,分子构型为八面体型
D. 单质硼属于原子晶体
难度: 中等查看答案及解析