-
2014年2月,我国中东部地区遭遇严重的雾霾天气,京津冀地区的空气污染级别高达6级,PM2.5值逼近1000(“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物).下列有关环境污染与防护的说法正确的是 ( )
A.CO2、NO、NO2都是大气污染气体,在空气中能稳定存在
B.使用清洁能源是防止酸雨发生的重要措施之一
C.PM2.5属于胶体,可以通过静电除尘装置除去
D.治理汽车尾气中的CO和NO2,可以通过催化转化装置,转化成无毒的CO2和NH3
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A.标准状况下,2.24 L苯中约含有个NA碳原子
B.标准状况下,22.4 L H2中含中子数为2NA
C.1 L 1 mol/L醋酸溶液中离子总数为2 NA
D.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子
难度: 中等查看答案及解析
-
下列变化属于物理变化的是 ( )
A.氧气在放电条件下变成臭氧
B.胆矾在加热条件下变成白色无水硫酸铜
C.漂白的草帽久置空气中变黄
D.氢氧化铁胶体加入硫酸镁产生沉淀
难度: 简单查看答案及解析
-
你认为下列数据可信的是 ( )
A. 某雨水的pH为5.6
B.某澄清石灰水的浓度是2.0 mol/L
C.某胶体粒子的直径是160 nm
D.某常见气体的密度为1.8 g/cm3
难度: 简单查看答案及解析
-
德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是 ( )
A.水、双氧水、水玻璃都是纯净物
B.石墨和C60互称为同位素
C.磷酸钙是可溶性强电解质
D.一定条件下石墨转化为C60是化学变化
难度: 简单查看答案及解析
-
由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2和CO的体积比为 ( )
A.29:8:13 B.22:1:14 C.13:8:29 D.26:15:57
难度: 简单查看答案及解析
-
下列对各组离子或物质是否能够大量共存解释正确的是 ( )
A
常温常压下NH3、O2、H2、CO2
不能共存
NH3为碱性气体,CO2为酸性气体,二者反应生成(NH4)2CO3
B
c(OH-)=1×10-13mol/L溶液中,Fe2+、NO3-、SO42-、Na+
不能共存
发生反应Fe2++NO3-+4H+=3Fe3++NO+2H2O
C
溶液中: K+、Cu2+、Cl-、NH3•H2O
不能共存
发生反应Cu2++2OH-=Cu(OH)2
D
溶液中Al3+、Na+、SO42-、HCO3-
可以共存
不能发生反应
难度: 中等查看答案及解析
-
下列各组离子或分子在溶液中能大量共存,且满足相应要求的是 (. )
选项
离子或分子
要求
A
K+ 、NO3-、Cl-、HS-
c(K+)<c(Cl-)
B
Fe3+、NO3-、SO32-、Cl-
滴加盐酸立即有气体产生
C
NH4+、Al3+、SO42-、CH3COOH
滴加NaOH溶液立即有气体产生
D
Na+、HCO3-、Mg2+、SO42-
逐滴滴加氨水立即有沉淀产生
难度: 中等查看答案及解析
-
MnO2的一些性质或用途如图,下列说法正确的是 ( )

A.①、②、③三个反应中MnO2均作氧化剂
B.足量MnO2与2 L 10 mol/LHCl共热,可生成5 mol C12
C.反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子
D.反应③中K2CO3和KNO3的化学计量数均为1
难度: 中等查看答案及解析
-
某溶液中可能含有K+、NH4+、Ba2+、SO42一、I一、 CO32一。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和CCl4振荡后静置,下层呈无色。为确定该溶液的组成,还需检验的离子是 ( )
A.K+ B.SO42一 C.Ba2+ D.NH4+
难度: 中等查看答案及解析
-
下列说法中正确的是 ( )
A.一定条件下向1 L容器内通入46 g NO2,则NO2的物质的量浓度一定为1 mol/L
B.标准状况下,22.4L的己烷中有20×6.02 × 1023个原子
C.1 mol氯气溶于水转移6.02× 1023个e—
D.0.1 mol CH5+含6.02 × lO23个e一
难度: 中等查看答案及解析
-
下列各选项中的两个反应,可用同一个离子方程式表示的是 ( )
选项
Ⅰ
Ⅱ
A
Ba(OH)2溶液与过量NaHCO3溶液混合
NaOH溶液与过量NaHCO3溶液混合
B
少量SO2通入Ba(OH)2溶液中
过量SO2通入Ba(OH)2溶液中
C
BaCl2溶液与Na2SO3溶液混合
Ba(OH)2溶液与H2SO3溶液混合
D
少量氨水滴入AlCl3溶液中
少量AlCl3溶液滴入氨水中
难度: 中等查看答案及解析
-
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”, S2O32-与Cl2反应的产物之一为SO42一。下列说法中,错误的是 ( )
A.该反应中的氧化剂是C12
B.SO2与氯水的漂白原理相同,所以可用S02做纺织工业的漂白剂
C.上述反应中,每生成1 mol SO42一,可脱去2 mol C12
D.根据该反应可判断还原性:S2O32->C1—
难度: 中等查看答案及解析
-
在T℃时,将ag NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为W,其中含NH4+的物质的量为bmol。下列叙述中正确的是 ( )
A.溶质的质量分数为
B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
C.溶液中
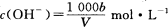
D.溶质的物质的量浓度
难度: 中等查看答案及解析
-
下列关于Na2O2的叙述,正确的是 ( )
A.Na2O2晶体中的阴离子与阳离子的物质的量之比为1:1
B.Na2O2晶体为离子晶体,且含极性共价键
C.Na2O2应保存于密封、干燥带玻璃塞的广口瓶中
D.Na2O2与盐酸反应,不仅有盐和水生成,同时会放出无色气体
难度: 简单查看答案及解析
-
下列说法中不正确的是 ( )
A.向滴有酚酞的水中加入过量Na2O2粉末并振荡,溶液由无色变红又变无色
B.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应是一个放热反应且有氧气生成
C.Na2O2与H2O反应是一个氧化还原反应,Na2O2既是氧化剂,又是还原剂
D.Na2O2与H2O反应是一个置换反应,有单质O2产生
难度: 简单查看答案及解析
-
将钠、镁各0.2 m01分别放入100 mL 1 mol/l的盐酸中, 同温同压下产生的气体体积之比是( )
A.1:2 B.1:3 C.2:1 D.1:l
难度: 简单查看答案及解析
-
观察是研究物质性质的一种基本方法.一同学将一小块金属钠露置于空气中,观察到下列现象:银白色→①变灰暗→②变白色→③出现液滴→④白色固体,下列说法中正确的是 ( )
A.①发生了氧化还原反应 B.②变白色是因为生成了碳酸钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液 D.④只发生物理变化
难度: 简单查看答案及解析
-
下列过程没有发生化学反应的是
A.用活性炭去除冰箱中的异味
B.用热碱水清除炊具上残留的油污
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D.用含硅胶、铁粉的透气小袋与食品一起密封包装
难度: 简单查看答案及解析
-
四联苯
的一氯代物有 ( )
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列反应中,反应后固体物质增重的是
A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液
难度: 中等查看答案及解析
-
下列图示实验正确的是 ( )

难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.1 mol Fel2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol/l硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4 NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
难度: 中等查看答案及解析