-
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是
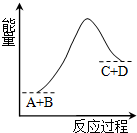
A.该反应为放热反应
B.该反应为吸热反应
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
难度: 简单查看答案及解析
-
下列说法或表示方法正确的是
A.反应物总能量低于生成物总能量时,该反应不能发生
B.强酸跟强碱反应放出的热量称为中和热
C.由石墨比金刚石稳定可知,C(石墨,固)=C(金刚石,固)△H>O
D.在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式表示为:2H2(g)十02(g)=2H2O(l);△H=-285.8KJ/mol
难度: 中等查看答案及解析
-
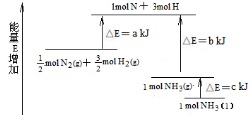
已知化学反应2C(s)+O2(g)
2CO(g);2CO(g) + O2(g)
2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
A.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
B.28gCO所具有的能量一定高于12gC所具有的能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将两份等质量碳燃烧,生成CO2的反应比生成CO的反应放出的热量多
难度: 中等查看答案及解析
-
下列有关反应能量变化图像的判断错误的是
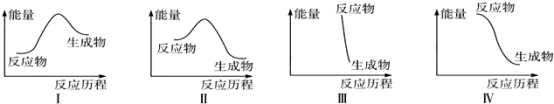
A.I可表示需加热的放热反应 B.Ⅱ可表示需加热的放热反应
C.Ⅲ可表示爆炸反应 D.Ⅳ可表示酸和碱的中和反应
难度: 中等查看答案及解析
-
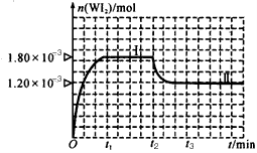
反应2SO2+O2
2SO3经a min后,SO3浓度的变化情况如图所示,在时间0--a min内用O2表示的平均反应速率为0.04mol/(L ·min),则a等于
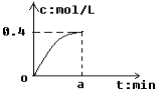
A. 0.1 B.2.5 C.5 D.10
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g) + H2(g) 在一可变容积的密闭容器中进行,下列条件的改变能使瞬间正反应速率增大的是
A.增加碳单质的量
B.保持体积不变,充入N2使体系压强增大
C.将容器的体积缩小一半
D.保持压强不变,充入N2使体系体积增大
难度: 中等查看答案及解析
-
甲、乙两容器中都在进行A
B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是
A.甲快 B.乙快 C.相等 D.无法确定
难度: 中等查看答案及解析
-
对于mA(s) + nB(g)
eC(g) + f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如右下图,下列叙述正确的是
A.达到平衡后,加入催化剂,则C%增大
B.达到平衡后,若升温,平衡逆向移动
C.化学方程式中n<e +f
D.达到平衡后,增加A的量,平衡正向移动
难度: 困难查看答案及解析
-
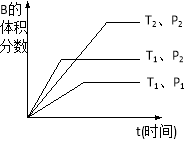
下图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是
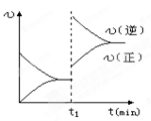
A.2SO2(g)+O2(g)
2SO3(g);△H<0
B.4NH3(g)+5O2(g)
4NO(g)+6H2O(g);△H<0
C.H2(g)+I2(g)
2HI(g);△H>0
D.N2(g) +3H2(g)
2 NH3(g) △H<0
难度: 中等查看答案及解析
-
反应4NH3+5O2
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是
A.v (O2)=0.0125 mol·(L·s)-1
B.v (NO)=0.01mol·(L·s)-1
C.v (H2O)=0.12 mol·(L·s)-1
D. v(NH3)=0.1 mol·(L·s)-1
难度: 中等查看答案及解析
-
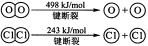
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.
H2SO4(aq)+
Ba(OH)2(aq)=
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
难度: 中等查看答案及解析
-
下列变化不能用勒夏特列原理解释的是
A.红棕色的NO2气体加压后颜色先变深再变浅
B.H2、I2、HI混合气体加压后颜色变深
C.二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率
D.打开汽水瓶,看到有大量的气泡逸出
难度: 简单查看答案及解析
-
对于N2(g)+3H2(g)
2NH3(g),不能作为反应达到平衡状态的判断依据是
A.恒容密闭容器中总压强不变
B.恒容密闭容器中混合气体的密度不变
C.生成氨气的速率与氨气分解的速率相等
D.N2、H2、NH3的浓度不再发生变化
难度: 中等查看答案及解析
-
反应L(s)+aG(g)
bR(g)达到平衡时,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断
A.上述反应正方向是吸热反应 B.上述反应正方向是放热反应
C.a>b D.a+1<b
难度: 困难查看答案及解析
-
在密闭容器中发生下列反应 aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原来的1.8倍,下列叙述正确的是
A.A的转化率变大
B.a<c+d
C.D的体积分数变大
D.平衡向正反应方向移动
难度: 中等查看答案及解析
-
在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是
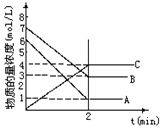
A.该反应的化学方程式为5A+4B
4C
B.2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
C.用B的浓度变化表示0-2min时间内的速率为2mol/(L·min)
D.2min前,正反应速率逐渐减小,逆反应速率逐渐增大,但是正反应速率大于逆反应速率。
难度: 困难查看答案及解析
-
在密闭容器中进行反应:X2(g)+Y2(g)
2Z(g)已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.Y2为0.15mol/L B.Z为0.2mol/L
C.X2为0.3mol/L D.Z为0.4mol/L
难度: 中等查看答案及解析
-
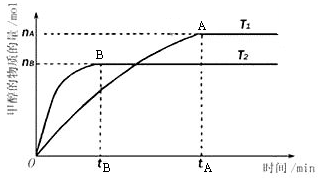
已知某可逆反应:2M(g)
N(g) △H<0。现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示。下列说法中,正确的是
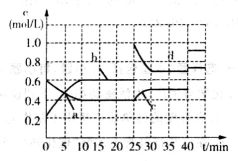
A.a、b、c、d四个点中处于平衡状态的点是a、b
B.反应进行至25 min时,曲线发生变化的原因是加入了0.4 mol N
C.若调节温度使35 min时体系内N的体积分数与15 min时相等,应升高温度
D.若在40 min时出现如图所示变化,则可能是因为加入催化剂引起的
难度: 极难查看答案及解析