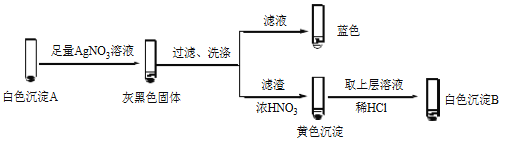
-
由下列实验及现象不能得出相应结论的是
选项
实验
现象
结论
A
向2 mL 0.01mol/L的 FeCl3溶液中加入1滴KSCN溶液,再加入足量铁粉,充分振荡
溶液变为红色,加入铁粉后红色褪去,变为浅绿色
Fe3+比Fe2+的氧化性强
B
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
湿润的红色石蕊试纸逐渐变蓝
NH4HCO3分解产生氨气
C
将一小块金属钠放置在空气中,一段时间后,将其放置在坩埚中加热
钠表面变暗,加热时,钠燃烧,发出黄色火焰
钠易与氧气反应,加热时生成Na2O的速率加快
D
向2支盛有2 mL相同浓度银氨溶液的试管中,分别加入2滴相同浓度的NaCl和NaI溶液
一支无明显现象,另一支产生黄色沉淀
相同条件下,AgI比AgCl的溶解度小
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
28g Cu、Ag合金与一定量某浓度的硝酸溶液完全反应,将放出的气体与2.24L(标准状况)O2混合通入水中,恰好被水完全吸收,则合金中Cu的质量为( )
A. 9.6g B. 6.4g C. 3.2g D. 4.8g
难度: 中等查看答案及解析
-
下列中国传统工艺, 利用氧化还原反应原理实现的是
A. 丹砂(HgS)炼汞
 B. 石灰石生产生石灰
B. 石灰石生产生石灰
C. 酒精蒸馏
 D. 桑蚕丝织锦
D. 桑蚕丝织锦
难度: 简单查看答案及解析
-
中国传统文化对人类文明贡献巨大,古代文献中记载了很多化学研究成果。下列常见古诗文对应化学知识正确的是
选项
古诗文
化学知识
A
《本草经集注》中记载鉴别硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,云是真硝石也。”
鉴别硝石和朴消利用了焰色反应
B
《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛。”
“强水”是指氢氟酸
C
《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折。”
剂钢为铁的合金,其硬度比纯铁的大,熔点比纯铁的高
D
《诗经·大雅·绵》:“堇茶如饴。”郑玄笺:“其所生菜, 虽有性苦者,甘如饴也。”
糖类均有甜味,且都能发生水解反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍。A、B、C三种元素的单质在适当条件下可发生如图所示的变化。下列说法正确的是

A. 甲、乙、丙三种物质的水溶液均显碱性
B. 甲是碱性氧化物,乙是酸性氧化物
C. 甲、乙可能都有漂白性,其漂白原理相同
D. 丙的水溶液在空气中长期放置,溶液可能会变浑浊
难度: 中等查看答案及解析
-
下列说法中正确的是
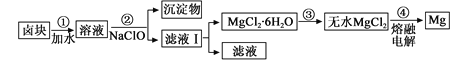
①钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用;②砹(At) 是第ⅦA族,其氢化物的稳定性大于HCl;③Na2FeO4可做水的消毒剂和净化剂;④陶瓷、玻璃、水晶、玛瑙、水泥、光导纤维的主要成分都是硅酸盐;⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应;⑥第三周期金属元素的最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱;⑦海水提镁的主要步骤为:
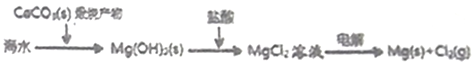
A. ①③④⑦ B. ①③⑥ C. ③④⑤⑦ D. ②④⑧
难度: 中等查看答案及解析
-
工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( )
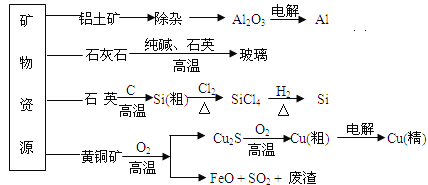
(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均只是还原产物
难度: 中等查看答案及解析